 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Деякі кислоти та їхні залишки
|
|
| Кислота | Кислотний залишок | |||
| Формула | Назва | Формула | Назва | |
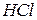
| Хлороводнева, хлоридна, соляна | 
| Хлорид-іон | |
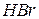
| Бромоводнева, бромідна | 
| Бромід-іон | |
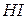
| Йодоводнева, йодидна | 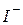
| Йодид-іон | |
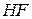
| Фтороводнева, фторидна | 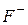
| Фторид-іон | |
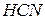
| Ціанистоводнева, ціанідна | 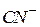
| Ціанід-іон | |

| Сірководнева, Сульфідна | 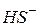
| Гідросульфід-іон, гідрогенсульфід-іон | |
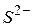
| Сульфід-іон | |||
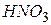
| Азотна, нітратна | 
| Нітрат-іон | |
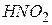
| Азотиста, нітритна, нітратна (Ш) | 
| Нітрит-іон | |
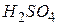
| Сірчана, сульфатна | 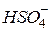
| Гідросульфат-іон, гідрогенсульфат-іон | |

| Сульфат-іон | |||
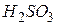
| Сірчиста, сульфітна, сульфатна(IV) | 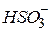
| Гідросульфіт-іон, гідрогенсульфіт-іон | |
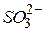
| Сульфіт-іон, сульфат (1V)-іон | |||
| Продовження табл. 1.2 | ||||
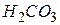
| Вугільна, карбонатна | 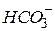
| Гідрокарбонат-іон, гідрогенкарбонат-іон | |

| Карбонат-іон | |||

| Кремнієва, силікатна | 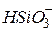
| Гідросилікат-іон, гідрогенсилікат-іон | |
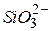
| Силікат-іон | |||
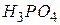
| Ортофосфорна, ортофосфатна | 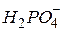
| Дигідрофосфат-іон, дигідрогенфосфат-іон | |
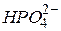
| Гідрофосфат-іон, гідрогенфосфат-іон | |||

| Фосфат-іон, ортофосфат-іон | |||

| Марганцева, перманганатна | 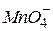
| Перманганат-іон, манганат(VП)-іон | |
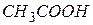
| Оцтова, ацетатна | 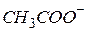
| Ацетат-іон | |
Характерними властивостями кислот є їхня здатність взаємодіяти з основами і основними оксидами з утворенням солей:

Амфотерні гідроксиди ― це гідроксиди, які виявляють основні та кислотні властивості залежно від умов – тобто від природи другого компонента, який бере участь у кислотно-основній взаємодії.
До амфотерних гідроксидів належать гідроксиди деяких металів головних підгруп (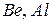 ), а також багатьох металів побічних підгруп періодичної системи елементів у проміжних ступенях окиснення:
), а також багатьох металів побічних підгруп періодичної системи елементів у проміжних ступенях окиснення: 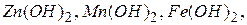
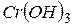 .
.
При взаємодії з кислотами амфотерні гідроксиди виявляють властивості основ, а при взаємодії з основами – властивості кислот:
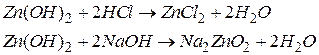
Назви амфотерних гідроксидів утворюються подібно до назв основ: 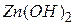 - гідроксид цинку.
- гідроксид цинку.
Солі можна розглядати як продукти повного або часткового заміщення атомів водню (гідрогену) у кислотах на атоми металів, або як продукти повного чи часткового заміщення гідроксильних груп в основах на кислотні залишки.
Розрізняють такі типи солей: нормальні або середні, кислі та основні.
Нормальні солі – це продукти повного заміщення атомів водню на атоми металу в молекулах кислот:

Кислі солі – це продукти неповного заміщення атомів водню на атоми металу в молекулах кислот:
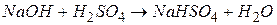
Основні солі – це продукти неповного заміщення гідроксильних груп у молекулі багатокислотної основи або амфотерного гідроксиду на кислотні залишки:
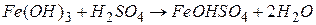
Можна вважати, що солі утворені із залишків основ і залишків кислот.
За міжнародними номенклатурними правилами назва солі складається з назви металу та латинської назви кислотного залишку. Наприклад,  – сульфат натрію або натрій сульфат.
– сульфат натрію або натрій сульфат.
У назві кислих солей до латинської назви аніона додають числівник, що відповідає числу атомів водню в молекулі кислоти і слово “гідроген”- або “гідро”-, або “дигідро”. Наприклад, 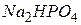 - гідрофосфат натрію,
- гідрофосфат натрію,  - дигідрофосфат натрію.
- дигідрофосфат натрію.
Аналогічно до назви катіона основної солі додають слово “гідроксо”-, наприклад: 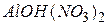 - нітрат гідроксоалюмінію,
- нітрат гідроксоалюмінію,  - нітрат дигідроксоалюмінію.
- нітрат дигідроксоалюмінію.
Дата публикования: 2015-09-18; Прочитано: 493 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
