 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Золь хлорида серебра получен при смешивании 20 мл 0,025 М раствора нитрата серебра и 40 мл 0,005 М раствора хлорида калия
|
|
Пример 1. Золь хлорида серебра получен при смешивании 20 мл 0,025 М раствора нитрата серебра и 40 мл 0,005 М раствора хлорида калия. Записать формулу мицеллы, объяснить её строение. Какой из электролитов: NaCl, Na2SO4, Na3PO4 обладает наибольшим порогом коагуляции, какой ион является ионом-коагулятором?
Дано:
V(p-pa AgNO3) = 20 мл
C(AgNO3) = 0,025 моль/л
V(p-pa KCl) = 40 мл
C(KCl) = 0,005 моль/л
 Ског (Х) −?
Ског (Х) −?
| Решение: запишем уравнение реакции: AgNO3 + KCl = AgCl¯ + KNO3 Для получения золя одно из реагирующих веществ должно быть взято в избытке. Поэтому вычисляем количество реагирующих веществ: v (KCl) = C(KCl).V(p-pa) = 0,005x0,04 = 0,0002 моль v (AgNO3) = C(AgNO3).V(p-pa) = 0,025x0,02 = |
0,0005моль (в избытке), поэтому строение мицеллы выражается формулой:
{ m AgCl. n Ag+.(n – x)NO3−} x +. x NO3−
| ядро |
 |адсорб. слой | диф. слой |
|адсорб. слой | диф. слой |

 | гранула |
| гранула |

 | мицелла |
| мицелла |
Ag+ − потенциалопределяющие ионы; суммарный их заряд больше суммарного заряда противоионов адсорбционного слоя и поэтому гранула имеет положитель-ный заряд. NO3− − противоионы; часть из них (n – x) находится в адсорбцион-ном, а оставшая часть (х) – в диффузном (или подвижном) слое. По правилу Шульце и Гарди ионом-коагулятором является ион добавляемого электролита, заряд которого противоположен заряду гранулы: в данном случае ионом-коагу-лятором является анион. Коагулирующая способность иона возрастает с увели-чением заряда, а порог коагуляции уменьшается. Значит:
Ског.(NaCl) > Ског.(Na2SO4) > Ског.(Na3PO4).
Пример 2. Определить средний сдвиг частицы золя за 15 с при температуре 20оС, если радиус частицы 5.10−8 м, вязкость среды 1.10−3 Па.с.
Дано:
t = 20oC, T = 293K
r = 5.10−8 м
h = 1.10−3 Па.с
R = 8,31 Дж/моль.K
t = 15 с
NA = 6,02.1023моль−1
 D −? D −?
| Решение: средний сдвиг частицы при броуновском движении вычисляется по уравнению Эйнштейна-Смолуховского:  , где , где  − коэффициент диффузии. − коэффициент диффузии.
|
 м2/с,
м2/с,
 м.
м.
Ответ: 9,26.10−6 м
Пример 3. Определить величину электрокинетического (дзета-)потенциала, если под напряжением 100 В граница окрашенного золя переместилась за 10 мин на 1 см. Расстояние между электродами 10 см, диэлектрическая проницаемость вакуума eо= 8,85 . 10-12 ф/м, относительная диэлектрическая проницаемость среды e = 81, вязкость дисперсионной среды 0,001 Па . с.
Дано:
e = 81
eо= 8,85.10-12 ф/м
h = 0,001 Па.с
l = 10 см = 0,1 м
t = 10 мин = 600 с
V = 100 B
s = 1 см = 0,01 м
 z =? z =?
| Решение: электрокинетический потенциал вычисляется по формуле:
 Ответ: 23 мВ.
Ответ: 23 мВ.
|
Пример 4. Гидрозоль сернистого мышьяка содержит 7,2 кг As2S3 в 1 м3. Средний радиус частиц 1 . 10−9 м. Вычислите частичную концентрацию золя и его осмотическое давление при t = 0оС, если плотность твердого As2S3 составляет 2,8 . 103 кг/м3. Частицы имеют сферическую форму.
| Дано: t = 0оС = 273 K d = 2,8.103 кг/м3 m(As2S3) = 7,2 кг V(золя) = 1 м3 r = 1.10−9 м Pосм −? | Решение: осмотическое давление золей рассчитывается по
формуле:  , где v − численная (или частичная) концентрация.
1) вычисляем массовую концентрацию: , где v − численная (или частичная) концентрация.
1) вычисляем массовую концентрацию:
 кг/м3 кг/м3
|
2) определяем массу одной частицы:

3) вычисляем численную концентрацию (число частиц в единице объема): 
4) вычисляем осмотическое давление золя: 
Ответ: 2,314 кПа
Пример 5. Коагуляция 100 мл золя Fe(OH)3 вызывается добавлением следую-щих количеств из электролитов: 10 мл раствора KCl с C(1/zX) = 1 моль/л, 63 мл раствора K2SO4 с C(1/zX) = 0,01 моль/л, 37 мл раствора K3PO4 с C(1/zX) = 0,001 моль/л. Вычислить пороги коагуляции электролитов и определить знак заряда коллоидной частицы.
Решение: вычисляем пороги коагуляции электролитов:
1) 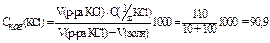 , ммоль/л
, ммоль/л
2)  , ммоь/л
, ммоь/л
3)  , моль/л
, моль/л
Как видно из формул солей, они состоят из одинакового катиона (K+) и анионов, разных зарядов. Так как пороги коагуляции у солей отличается много-кратно, причем, при переходе от однозарядного хлорид-иона к 2-х зарядному сульфат-иону, а далее к трехзарядному фосфат-иону, то ионом коагулятором является анион. В соответствии с правилом Шульце и Гарди, гранула золя имеет положительный заряд.
Вопросы и задачи для самоподготовки
1. Что является предметом изучения, задачей коллоидной химии? Какие методы исследования она использует?
2. Каковы основные этапы и роль отдельных ученых в развитии коллоидной химии?
3. По каким признакам Т.Грэм разделил все вещества на кристаллоиды и коллоиды, что означают эти названия? В чём состоит относительность такого разделения веществ, кто выявил эту относительность?
4. Классификация дисперсных систем по агрегатному состоянию фаз (объяснения и примеры).
5. Классификация дисперсных систем по размерам частиц дисперсной фазы.
6. Классификация дисперсных и коллоидных систем по характеру взаимо-действия дисперсионной среды и дисперсной фазы.
7. Классификация дисперсных систем по взаимодействию частиц (по подвиж-ности дисперсной фазы). Дать объяснения и привести примеры.
8. Дать определение коллоидным системам. Из каких фаз они состоят?
9. Что представляют собой молекулярно-дисперсные системы, каковы их основные признаки?
10. Отличительные признаки коллоидных систем сравнительно с другими дисперсными системами.
11. В чем состоит получение коллоидных систем методом физического диспергирования? Разновидности метода, их применение и практическое значение.
12. Что такое химическое диспергирование − пептизация? Дать объяснения и привести пример.
13. Получение коллоидных систем методом физической конденсации. Разновидности метода и их применение.
14. Получение коллоидных систем методом химической конденсации. Разновидности метода и их применение.
15. Почему приходится очищать коллоидные растворы от примесей низкомо-лекулярных веществ? Какие методы для этого применяются? Что такое диализ, электродиализ и ультрафильтрация?
16. Какое значение при лечении больных и в производстве лекарственных препаратов имеют диализ, электродиализ и ультрафильтрация?
17. Чем обусловлено броуновское движение частиц в коллоидных растворах, отчего зависит его интенсивность? Среднее смещение (сдвиг) частиц.
18. Что такое диффузия, ее физический смысл и как она проявляется в коллоидных системах? Какие характеристики коллоидных частиц позволяет установить определение скорости их диффузии?
19. Как проявляется осмотическое давление в коллоидных растворах, чем оно отличается от осмотического давления истинных растворов?
20. Какие особенности присущи вязкости лиофобных коллоидных растворов по сравнению с вязкостью истинных растворов? Уравнение Эйнштейна, его применимость.
21. Что такое седиментация частиц и седиментационное равновесие в коллоидных системах? Какие количественные параметры их характеризуют?
22. Какие различают виды взаимодействия света с веществом? Как и почему происходит рассеяние света в коллоидных системах? В чем состоит явление Фарадея-Тиндаля?
23. Отчего зависит интенсивность рассеяния света в коллоидных системах? Что такое опалесценция, чем она обусловлена? Дать объяснения, привести примеры.
24. В каком случае интенсивность рассеяния света коллоидным раствором больше: при освещении синим светом (λ= 410 нм) или красным светом (λ=630 нм)? Ответ обосновать.
25. Что такое ультрамикроскопия? Какие характеристики коллоидных систем могут быть определены этим методом?
26. Какое строение имеют коллоидные частицы лиофобных золей. Дать объяснение и привести примеры.
27. Что такое электротермодинамический (фи-) и электрокинетический (дзета-) потенциалы коллоидных частиц, что они характеризуют и отчего зависят?
28. Что представляют явления электрофореза и электроосмоса в коллоидных системах, каков их механизм, где и как они используются?
29. Что такое агрегативная устойчивость коллоидных систем? Каковы факторы
агрегативной устойчивости, что является количественной мерой её?
30. Что такое кинетическая устойчивость коллоидных систем? Каковы факторы кинетической устойчивости, что является количественной мерой такой устойчивости?
31. Какой процесс называют коагуляцией? Какими способами можно вызвать коагуляцию в лиофобных коллоидных системах?
32. Как изменяются число частиц и их порядок при коагуляции?
33. В чем состоит правило Шульца-Гарди для коагулирующего действия электролитов? Как объясняется различная коагулирующая способность ионов электролитов по современным представлениям?
34. Что такое порог коагуляции золей электролитами? Для чего нужна эта величина, отчего она зависит? Что выражает коагулирующая способность, отчего зависит?
35. Каким образом ионы электролитов вызывают коагуляцию коллодных частиц? Рассмотреть механизмы коагулирующего действия электролитов.
36. Как и почему скорость коагуляции золей зависит от концентрации коагулирующего электролита? Какие виды коагуляции различают в зависимости от ее скорости?
37. Как происходит коагуляция золей смесями электролитов (совместная коагуляция)? Дать объяснения, привести примеры и графики.
38. Что представляет взаимная коагуляция золей, где она используется?
39. Каким образом метод капилляризации позволяет определить знак заряда коллодных частиц? Определить знак заряда коллоидной частицы и написать формулу мицеллы золя берлинской лазури, полученного смешением растворов гексацианоферрата (II) калия и хлорида железа (III), учитывая, что фильтровальная бумага, конец которой опущен в указанный золь окрашена синим цветом.
40. Указать, какой вид будет иметь пятно золи, нанесенное на фильтровальную бумагу. Золь получен при взаимодействии избытка хлорида железа (III) и гексацианоферрата (II) калия. Определить заряд коллоидной частицы, написать формулу мицеллы.
41. Свежеосажденный гидроксид алюминия обрабатывали небольшим коли-чеством соляной кислоты, в результате чего часть осадка растворилось с образованием хлорида алюминия по реакции Al(OH)3 + HCl ® AlCl3 + H2O. При этом образовался золь гидроксида алюминия. Указать каким методом получен золь, привести формулу мицеллы и объяснить её строение.
42. Свежеосажденный гидроксид алюминия обрабатывали небольшим количес-твом соляной кислоты, в результате чего часть осадка растворилось с обра-зованием основной соли по реакции Al(OH)3 + HCl ® Al(OH)2Cl + H2O. При этом образовался золь гидроксида алюминия. Указать каким методом получен золь, привести формулу мицеллы и объяснить её строение.
43. Свежеосажденный гидроксид алюминия обрабатывали небольшим коли-чеством соляной кислоты, в результате чего часть осадка растворилось с образованием основной соли по реакции Al(OH)3 + HCl ® Al(OH)Cl2 + H2O.
При этом образовался золь гидроксида алюминия. Указать каким методом получен золь, привести формулу мицеллы и объяснить её строение.
44. Свежеосажденный гидроксид алюминия обрабатывали небольшим коли-чеством щелочи, в результате чего часть осадка провзаимодействовала с образованием гидроксоалюмината натрия по реакции Al(OH)3 + NaOH ® Na[Al(OH)4]. При этом образовался золь гидроксида алюминия. Указать каким методом получен золь, написать формулу мицеллы, объяснить её строениие.
45. Свежеосаждённый гидроксид железа (III) обрабатывали небольшим коли-чеством раствора хлорида железа (III), в результате чего часть осадка про-взаимодействовала с образованием золя Fe(OH)3. Указать каким методом получен золь, написать формулу мицеллы, объяснить её строение.
46. Золь ферроцианата меди был получен при добавлении к раствору сульфата меди избытка раствора желтой кровяной соли K4[Fe(CN)6]. Указать каким методом получен золь, написать формулу мицеллы, объяснить ее строение.
47. Золь ферроцианата меди был получен при добавлении к раствору желтой кровяной соли K4[Fe(CN)6] избытка раствора сульфата меди. Указать каким методом получен золь, написать формулу мицеллы, объяснить ее строение.
48. Рассмотреть возможные варианты строения коллоидных частиц хлорида серебра, полученных при смешении растворов AgNO3 и KCl.
49. Напишите формулу мицеллы золя иодида серебра, полученного добавлением к 30 мл 0,006 М раствора иодида калия 40 мл 0,004 М раствора нитрата серебра. Укажите способ получения золя.
50. Золь золота получен при действии на избыток аурата калия (KAuO2) фор-мальдегида (CH2O) в щелочной среде по реакции: KAuO2 + CH2O + K2CO3 → Au(тв) + HCOOK + KHCO3 + H2O. Указать каким методом получен золь, написать формулу мицеллы, объяснить её строение.
51. Золь золота получен при смешении пероксида водорода и избытка раствора «золотой соли» по реакции H2O2 + HАuCl4 → Au(тв) + HCl + O2.Указать метод получения золя, написать формулу мицеллы, объяснить её строение.
52. Золь серы получен добавлением 5 мл раствора серы в этиловом спирте к 30 мл дистиллированной воды. Каким методом получен золь, объяснить его физический механизм.
53. При длительном стоянии сероводородной воды в результате окисления H2S кислородом воздуха образуется сера в коллоидном состоянии. Указать метод получения золя серы, написать формулу мицеллы, объяснить её строение.
54. Золь гидроксида железа (III) получен при добавлении к 85 мл кипящей дистиллированной воды 15 мл 2%-ного раствора хлорида железа (III). При этом соль частично подвергается гидролизу по реакции FeCl3 + H2O → Fe(OH)3(тв) + HCl. Написать возможные формулы мицелл золя гидроксида железа, учитывая, что при образовании его частиц в растворе присутствуют ионы Fe3+, FeO+, H+ и Cl. Каким методом получен золь?
55. Каков средний сдвиг частиц при броуновском движении, если радиус их 6,5 . 10−6 м, время наблюдения 1 с, вязкость дисперсионной среды 1 . 10−3 Н . с/м,
Т = 298 K, R = 8,31 Дж/К.моль. Ответ: 1,47 . 10−7м.
56. Определить величину среднего сдвига частиц дыма хлорида аммония при 273 K за время 5 с, если радиус частиц 1 . 10−8 м, вязкость воздуха 1,7 . 10−5 Н . с/м2. R = 8,31.Дж/К.моль.
57. Определить величину среднего сдвига при броуновском движении у частиц гидрозоля Fe(OH)3 при T = 293 K за время 4 с, если радиус частиц 1 . 10−8 м, вязкость воды 1 . 10−3 Н . с/м2. R = 8,31.Дж/К.моль. Ответ: 2,23 . 10−5м.
58. Определить величину дзета-потенциала, если под напряжением 100 В гра-ница золя переместилась за 15 мин на 1,5 см. Расстояние между электродами 20 см, диэлектрическая проницаемость вакуума eо= 8,85 . 10−12 ф/м, относи-тельная диэлектрическая проницаемость среды e = 81, вязкость диспер-сионной среды 0,001 Па . с. Ответ: 46 мВ.
59. Вычислить электрофоретическую подвижность частиц золя Fe(OH)3, если граница золя под напряжением 150 В переместилась за 10 мин на 7,5 мм. Расстояние между электродами 15 см. Ответ: 1,25 . 10−8 В/м.с.
60. Определите величину электрофоретической подвижности, если к двум элек-тродам, находящимся на расстоянии 30 см, приложено напряжение в 100 В. При этом за 15 мин наблюдалось перемещение окрашенного золя на 10 мм. Ответ: 3,33 . 10−9 В/м.с.
61. При электрофорезе гидрозоля гидроксида железа (III) к двум электродам, находящимся на расстоянии 15 см, приложено напряжение в 150 В. При этом
за 10 мин наблюдалось перемещение окрашенного золя на 7,5 мм. Диэлек-трическая проницаемость вакуума eо= 8,85 . 10−12 ф/м, относительная диэлек-трическая проницаемость среды e = 81, вязкость системы 0,001 Па . с. Вычислите величину электрокинетического потенциала. Ответ: 17,4 мВ.
62. При электрофорезе частицы золя хлорида серебра, полученного смешиванием равных объёмов раствора нитрата серебра с концентрацией 0,005 моль/л и хлорида натрия, перемещаются к катоду. Определите знак заряда коллоидной частицы и напишите формулу мицеллы. В каком диапозоне находилось значение концентрации раствора хлорида натрия?
63. При электрофорезе частицы золя хлорида серебра, полученного смешива-нием равных объёмов раствора нитрата серебра с концентрацией 0,005 моль/л и хлорида натрия, перемещаются к аноду. Определите знак заряда коллоидной частицы и напишите формулу мицеллы. В каком диапозоне находилось значение концентрации раствора хлорида натрия?
64. При смешении равных объемов гексацианоферрата (II) калия и хлорида железа (III) получили золь берлинской лазури (гексацианоферрата (II) железа (III) − Fe4[Fe(CN)6]3, который в электрическом поле перемещается к аноду. Какое вещество служит стабилизатором, концентрация какого раствора было больше? Напишите формулу мицеллы. Объясните её строение.
65. Какой минимальный объем раствора сульфида аммония с концентрацией 0,001 моль/л следует добавить к 15 мл раствора хлорида марганца (II) с концентрацией 0,003 М для того, чтобы получить золь с отрицательно заряженными частицами? Ответ: больше 45 мл.
66. Вычислить мицеллярную массу частиц гидрозоля сернистого мышьяка As2S3, если форма частиц сферическая, их средний радиус 1 . 10−8 м, плотность твердого As2S3 составляет 2,8 . 103 кг/м3. Ответ: 7057 а.е.
67. Вычислите осмотическое давление золя при 0оС, если в единице объема золя содержится 1,02.1023 мицелл As2S3. Ответ: 384 Па.
68. Гидрозоль сернистого мышьяка содержит 7,2 кг As2S3 в 1 м3. Средний ра-диус частиц 1 . 10−9 м. Вычислите частичную концентрацию золя и его осмо-тическое давление при t = 0оС, если плотность твердого As2S3 составляет 2,8 . 103 кг/м3. Частицы имеют сферическую форму. Ответ: 2578 Па.
69. Определить осмотическое давление гидрозоля золота, если его массовая концентрация Cв = 2 кг/м3, форма частиц сферическая, средний радиус 3 . 10−9 м, плотность золота 19,3.103 кг/м3, Т = 293 К. Ответ: 3,709 Па.
70. Золь хлорида серебра получен при смешивании равных объёмов 0,0095 М раствора КСl и 0,012 М раствора AgNО3. Какой из электролитов − K3[Fe(CN)6], K4[Fe(CN)6] или MgSO4 будет обладать наименьшей коагулирующей способностью и почему?
71. Явная коагуляция 2 л золя гидроксида алюминия наступила при добавлении 10,6 мл раствора K4[Fe(CN)6] с концентрацией 0,01 моль/л. Вычислите порог коагуляции золя гексацианоферрат-ионами; напишите формулу мицеллы золя гидроксида алюминия. Ответ: 0,053 ммоль/л.
72. Золь хлорида серебра получен смешиванием растворов нитрата серебра и хлорида натрия. Пороги коагуляции этого золя электролитами KNO3, Mg(NO3)3, AlCl3 равны 50; 0,8 и 0,06 ммоль/л соответственно. Как относятся между собой величины коагулирующих способностей электролитов? Укажите коагулирующие ионы и знак заряда гранулы коллоидной частицы.
73. Для изучения явления коагуляции к золю золота, стабилизированному ауратом калия (KAuO2), были добавлены электролиты NaCl, BaCl2 и FeCl3. У какого из этих электролитов будет наименьший порог коагуляции и почему?
74. Коагуляция 100 мл золя Fe(OH)3 вызывается добавлением следующих количеств какого либо из электролитов: 10,5 мл раствора KCl с C(1/zX) = 0,1 моль/л, 62,5 мл раствора Na2SO4 с C(1/zX) = 0,01 моль/л, 37 мл раствора Na3PO4 с C(1/zX) = 0,001моль/л. Вычислить пороги коагуляции электролитов и определить знак заряда коллоидной частицы.
75. Коагуляция 100 мл золя Fe(OH)3 вызывается добавлением следующих коли-честв какого либо из электролитов: 10 мл раствора KCl с C(1/zX) = 1 моль/л, 63 мл раствора K2SO4 с C(1/zX) = 0,01 моль/л, 37 мл раствора K3PO4 с C(1/zX) = 0,001 моль/л. Вычислить пороги коагуляции электролитов и определить знак заряда коллоидной частицы.
76. В трех колбах содержатся по 20 мл золя гидроксида железа. В первой колбе коагуляция наблюдалась при добавлении к золю 2,1 мл раствора NaCl с мо-лярной концентрацией эквивалента 1 моль/л, во второй − 12,5 мл раствора Na2SO4 с С(1/2 Х) = 0,01 моль/л, в третей колбе − 7,4 мл раствора Na3[Fe(CN)6] с С(1/3Х) = 0,001 моль/л. Вычислите пороги коагуляции элек-тролитов, определите знак заряда коллоидной частицы.
77. Для коагуляции 10 мл золя хлорида серебра можно добавить один из сле-дующих растворов электролитов: 2 мл 1 N раствора NaNO3, 12 мл 0,01 N раствора Ca(NO3)2, 7 мл 0,001N раствора Al(NO3)3. Вычислите пороги коа-гуляции электролитов и определите знак заряда частиц золя.
78. Определите знак заряда коллоидной частицы, если известно, что пороги коагуляции электролитов составляет (в ммоль/л): Cк(AlCl3) = 0,093; Cк(MgCl2) = 0,71; Cк(NaCl) = 51; Cк(KNO3) = 50; Cк(Al(NO3)3) = 0,095 и Cк(MgSO4) = 0,81. Расположите ионы в ряд по коагулирующей способности.
79. Пороги коагуляции некоторого золя электролитами оказались равными (в ммоль/л): Cк(NaNO3) = 300; Cк(Na2SO4) = 295; Cк(MgCl2) = 25 и C(AlCl3) = 0,5. Определите знак заряда коллоидной частицы. Ответ обосновать.
80. Пороги коагуляции некоторого золя электролитами составляет (в ммоль/л): Cк(NaNO3) = 250; Cк(Mg(NO)3) = 20; Cк(FeCl3) = 0,5 и C(Al(NO3)3) = 0,6, Cк(NaCl) = 255. Определите знак заряда частицы. Ответ обосновать.
81. Вычислите порог коагуляции раствора сульфата натрия, если добавление 3 мл 0,1N раствора Na2SO4 вызывает коагуляцию 15 мл некоторого золя.
82. Золь сульфида кадмия получен смешиванием равных объёмов растворов Na2S и Cd(NO3)2. Пороги коагуляции для различных электролитов имеют следующие значения (ммоль/л): Cк(Ca(NO)3) = 265, Cк(NaCl) = 250, Cк(MgCl2) = 290, Cк(Na3PO4) = 0,4, Cк(Na2SO4) = 15, Cк(AlCl3) = 300. Определите знак заряда частицы золя и напишите формулу мицеллы золя.
83. Золь гидроксида меди получен при сливании 100 мл 0,05 N раствора NaOH и 250 мл 0,001 N раствора Cu(NO3)2. Какой из прибавленных электролитов − KBr, Ba(NO3)2, K2CrO4, Al(NO3)3, MgSO4, ThCl4 имеет наименьший, и какой наибольший порог коагуляции? Ответ обосновать.
84. Порог коагуляции золя гидроксида железа (III) фосфат-ионами равен 0,37 ммоль/л. Какой объем 5%-ного раствора фосфата натрия (плотность раствора 1,05 г/мл) потребуется для коагуляции 750 мл золя?
85. Какой объем 0,001 М раствора хлорида железа (III) надо добавить к 0,03 л 0,002 М раствора нитрата серебра, чтобы частицы золя хлорида серебра в электрическом поле двигались к аноду? Напишите формулу мицеллы золя, объясните её строение. Какой из электролитов вызовет коагуляцию этого золя с наименьшим порогом коагуляции: KCl, Ba(NO3)2, MgSO4, AlCl3, K2SO4, Na3PO4?
86. К 100 мл 0,03%-ного раствора NaCl (плотность 1 г/мл) добавили 250 мл 0,001 М раствора нитрата серебра. Напишите формулу мицеллы золя, объясните её строение. К какому электроду будут двигаться частицы образующегося золя в электрическом поле? Какой из электролитов вызовет коагуляцию этого золя с наименьшим порогом коагуляции: KCl, Ba(NO3)2, MgSO4, AlCl3, K2SO4, Na3PO4?
Глава 7. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3, ПК-5.
7.1. СВОЙСТВА РАСТВОРОВ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Теоретическое пояснение: высокомолекулярными соединениями (ВМС) называют вещества с молекулярной массой от нескольких тысяч до нескольких миллионов. Их молекулы состоят из большого числа одинаковых группировок атомов (звеньев), связанных между собой ковалентными связями.
ВМС классифицируют по происхождению, химическому составу цепи, структуре макромолекул, методу получения, отношению к нагреванию и т.п.
По происхождению различают природные, искусственные и синтетические полимеры.
Природные полимеры получаются в процессе биосинтеза в клетках живых и растительных организмов. Примерами таких ВМС являются целлюлоза, крахмал [C6H11O5] n, различные белки [−CH(R)-CO-NH-CH(R)−] n, аминокислоты, ферменты, гормоны. В настоящее время осуществляется синтез белковых соединений, что позволит обеспечить человечество белковым рационом и создать лекарственные препрараты.
Искусственные полимеры (целлюлоза, лигнин, белки, нуклеиновые кислоты, натуральный каучук, шерсть, шелк) получают из природных материалов путем выделения, очистки и переработки природных полимеров.
Синтетические полимеры производят из различных низкомолекулярных соединений с кратными связями, напряженными циклами, подвижными функциональными группами путем их объединения в линейные цепи или блоки различной разветвленности и степени сшитости в трехмерные макромолекулы. К таким полимерам относят полиэтилен [−CH2-CH2−] n, политетрафторэтилен или фторпласт [−CF2-CF2−] n, полистирол [−CH2-CH(C6H5)−] n, каучуки [−CH2-CH=CH-CH2−] n, капрон [−CO-(CH2)5-NH−] n и др.
По строению макромолекул различают линейные, разветвленные и трехмерные (сетчатые), а по химическому составу карбоцепные, гетероцепные и элементорганические полимеры.
Свойства ВМС определяются химическим составом, строением, взаимным расположением молекул.
Растворы ВМС, ввиду большого размера макромолекул, проявляют свойства, схожие с лиофобными коллоидными растворами. Макромолекулы так же, как и коллоидные частицы, имеют малую скорость движения, не способны проникать через полупроницаемые мембраны, образуют осадки, рассеивают свет, проявляя эффект Фарадея-Тиндаля. В отличие от коллоидных веществ, ВМС образуют термодинамически устойчивые истинные растворы. Это проявляется в том, что растворение полимеров происходит самопроизвольно, без затраты энергии, им несвойственна коагуляция. В связи с этим, растворы полимеров рассматривают как лиофильные коллоидные системы.
Устойчивость растворов ВМС объясняется двумя факторами: наличием соль-ватной оболочки (главный фактор) и электрического заряда. Сольватная обо-лочка макромолекул возникает в результате притяжения к их полярным группам
и упорядоченной ориентации дипольных молекул воды. При разрушении соль-ватных оболочек макромолекулы теряют устойчивость, самопроизвольно объе-диняются и выпадают в осадок. Это происходит при добавлении к растворам ВМС низкомолекулярных веществ с высокой полярностью их молекул или ионов. Такими водоотнимающими средствами являются низшие спирты, средние соли сильных кислот и оснований. Молекулы этих веществ сильно гидрати-руются и образуют собственные сольватные оболочки, отнимая воду из соль-ватных оболочек макромолекул. Осаждение полимеров вследствие разрушения сольватных оболочек и потери устойчивости макромолекул называется высали-ванием. Как установил Гофмейстер, по способности гидратироваться и по выса-ливающему действию различные ионы образуют определенную последователь-ность, называемая лиотропным рядом:
анионы: цитрат-ион3− > SO42− > F− > CH3COO− > Cl− > NO3− > I− > CNS−
катионы: Li+ > Na+ > K+ > Rb+ > Cs+ > Mg2+ > Ca2+ > Sr2+ > Ba2+
Высаливание полимеров, в отличие от коагуляции, обратимо. При удалении высаливающего соединения, например, путем диализа, макромолекулы восста-навливают свои сольватные оболочки и осажденный полимер самопроизвольно растворяется. Это позволяет использовать высаливание при очищении отдель-ных белков, при получении различных биопрепаратов в фармацевтической и микробиологической промышленности.
 Рис.9. Графическое определение молекулярной массы полимера
Рис.9. Графическое определение молекулярной массы полимера
| Растворы полимеров проявляют опреде-ленное осмотическое давление, которое резко повышается при увеличении кон-центрации раствора. Это объясняется ки-нетикой не только самих макромолекул, но и отдельных сегментов макромолекул (участка цепи). Причем, с ростом кон-центрации число их увеличивается нели-нейно. Осмотическое давление растворов ВМС рассчитывают по уравнению Галлера:  , ,
|
где Сm − массовая концентрация полимера, K – вириальный коэффициент, учитывающий форму и гибкость макромолекулы.
Постоянство осмотического давления растворов полимеров позволяет использовать осмометрический метод для определения молекулярной массы. Для этого измеряют осмотическое давление растворов разной концентрации поли-меров и графически (рис.9) определяют его молекулярную массу.
В биолоических системах суммарное осмотическое давление создается низкомолекулярными веществами и биополимерами. Это давление называется
онкотическим давлением. Оно косвенно отражает транспорт питательных веществ и конечных продуктов обмена.
Макромолекулы полимеров могут иметь определенный заряд. В отличие от коллоидных частиц, заряд у макромолекул возникает не за счет избирательной адсорбции ионов, а вследствие диссоциации собственных ионогенных групп. Полимеры, имеющие ионогенные группы, называют полиэлектролитами. В зави-симости от знака заряда различают поликатиониты (имеют положительно заря-женные группы), полианиониты (имеют отрицательно заряженные группы) и полиамфолиты, имеющие как отрицательно, так и положительно заряженные группы. Примерами полиамфолитов являются нуклеиновые кислоты, белки и другие биополимеры, молекулы которых содержат карбоксильные (−COOH), амино- (−NH2) и другие функциональные группы. Ввиду наличия разноименно заряженных групп общий суммарный заряд полиамфолитов и их устойчивость зависят от рН раствора. При некотором значении рН раствора степень диссоциа-ции противоположно диссоциирующих групп оказывается равной и число поло-жительных и отрицательных зарядов макромолекулы уравнивается. Такое сос-тояние электронейтральности называют изоэлектрическим, а значение рН рас-твора – изоэлектрической точкой. В изоэлектрическом состоянии устойчивость, степень набухания, растворимость ВМС, вязкость и осмотическое давление их растворов будут наименьшими, что объясняется уменьшением степени сольватации макромолекул из-за уменьшения общего числа заряженных групп.
Высокая устойчивость ВМС в растворе обуславливает защитное действие их на гидрофобные коллоидные частицы. При добавлении полимера к коллоидному раствору его молекулы адсорбируются на коллоидные частицы и придают им гидрофильный характер. Коллоидные частицы окружаются сольватными оболоч-ками макромолекул полимера и поэтому коллоидные системы становятся более устойчивыми к коагулирующему действию электролитов. Это явление назы-вается коллоидной защитой. Защитное действие полимеров на коллоидные частицы измеряется защитными, например, железным, рубиновым, золотым, серебряным числами. Это минимальная масса сухого полимера, необходимого для защиты 10 мл золя от коагуляции при введении в золь 1 мл 10%-ного коагулирующего электролита.
Явление коллоидной защиты имеет место и в организме. Например, белки плазмы крови защищают от объединения и роста частиц труднорастворимых солей мочевой, щавелевой, фосфорной и желчных кислот. Понижение степени такой защиты служит предрасполагающим моментом при отложении камней в моче- и желчевыводящих путях и в развитии подагры.
Лабораторная работа
Дата публикования: 2015-09-18; Прочитано: 25945 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
