 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Вычислите по данным сталагмометрического исследования поверх-ностное натяжение этанола при 250С
|
|
Пример 1. Вычислите по данным сталагмометрического исследования поверх-ностное натяжение этанола при 250С, если число капель воды – 32, а спирта 64. Поверхностное натяжение воды при этой температуре равно 72,56 мДж/м2.
Дано:
s(Н2О) = 72, 56 мДж/м2
N(H2O) = 32
N(спирта) = 64
 s(спирта) −? s(спирта) −?
| Решение: поверхностное натяжение этанола вычисляем относительно поверхностного натяжения воды по формуле:
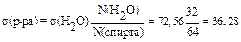 мДж/м2
Ответ: 36,28 мДж/м2 мДж/м2
Ответ: 36,28 мДж/м2
|
Пример 2. Предельная адсорбция ПАВ некоторым адсорбентом составляет 0,005 моль/г. Вычислите массу адсорбированного ПАВ из раствора равновесной кон-центрацией 0,1 моль/л адсорбентом массой 2 г. Относительная молекулярная масса ПАВ равна 60, а константа равновесия 0,06 моль/л.
Дано:
Гмакс = 0,005 моль/г
С = 0,1 моль/л
K = 0,06 моль/л
 m(адсорбента) = 2 г
m(ПАВ) −? m(адсорбента) = 2 г
m(ПАВ) −?
| Решение:
1) величина адсорбции вычисляем по уравнению Ленгмюра:  (моль/г)
2) количество ПАВ, адсорбированное двумя граммами адсорбента будет 2 раза больше:
v (ПАВ) = 2Г = 0,0062 моль
3) вычисляем массу ПАВ:
m(ПАВ) = v (ПАВ).М = 0,0062.60 = 0,37 г.
Ответ: 0,37 г. (моль/г)
2) количество ПАВ, адсорбированное двумя граммами адсорбента будет 2 раза больше:
v (ПАВ) = 2Г = 0,0062 моль
3) вычисляем массу ПАВ:
m(ПАВ) = v (ПАВ).М = 0,0062.60 = 0,37 г.
Ответ: 0,37 г.
|
Пример 3. Определить адсорбцию масляной кислоты при 290 K, если для её растворов при концентрации 0,0103 кмоль/м3 значение поверхностного натяжения равно 65,45.10−3 Дж/м2, а при 0,0206 кмоль/м3 – 59,78.10−3 Дж/м2. R =8,314.103Дж/(кмоль.К).
Дано:
T = 290 K
C1 = 0,0103 кмоль/м3
s1 = 65,45.10−3 Дж/м2
C2 = 0,0206 кмоль/м3
s1 =59,78.10−3 кмоль/м3
 R = 8,314.103Дж/(кмоль.К)
Г −? R = 8,314.103Дж/(кмоль.К)
Г −?
| Решение: адсорбция жидкости на жидкой поверхности вычисляется по уравнению Гиббса:  Ответ: 3,6.10−9 кмоль/м2
Ответ: 3,6.10−9 кмоль/м2
|
Пример 4. Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 2,6 и 0,6 мл. Вычислите величину адсорбции.
| Дано: m(адсорбента) = 2 г V1(CH3COOH) = 50 мл V2(CH3COOH) = 20 мл C(NaOH) = 0,1 моль/л V1(NaOH) = 2,6 мл V2(NaOH) = 0,6 мл Г −? | Решение: адсорбция жидкости на твердой поверхности вычисляется по уравнению:  1) вычисляем концентрации кислоты до и после адсорбции по закону эквивалентов:
1) вычисляем концентрации кислоты до и после адсорбции по закону эквивалентов:
 моль/л моль/л
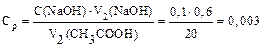 2) вычисляем адсорбцию:
2) вычисляем адсорбцию:
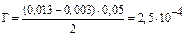 моль/г
Ответ: 0,25 ммоль/г. моль/г
Ответ: 0,25 ммоль/г.
|
Пример 5. Величина предельной адсорбции бутанола составляет 7,69.10−6 моль/м2. Вычислите площадь, занимаемой одной молекулой и длину молекулы бутанола. Плотность бутанола равна 0,809 г/мл, молярная масса 74 г/моль.
Дано:
Гмакс = 7,69.10−6 моль/м2
d = 0,809 г/мл
M(C4H9OH) = 74 г/моль
NA = 6,02.1023
 S −?
l −? S −?
l −?
| Решение:
1) площадь, занимаемой одной молекулой в плотном мономолекулярном слое вычисляем по формуле:
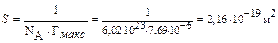 2) длину молекулы рассчитываем по формуле:
2) длину молекулы рассчитываем по формуле:
 Ответ: S = 2,16.10−19 м2; l = 7,03.10−10 м.
Ответ: S = 2,16.10−19 м2; l = 7,03.10−10 м.
|
Вопросы и задачи для самоподготовки
1. Что такое молекулярное давление и свободная поверхностная энергия?
2. Поверхностное натяжение. Методы его определения. Что представляет собой сталагмометрический метод определения поверхностного натяжения растворов, каковы границы его использования?
3. Что такое абсорбция, адсорбция, адсорбент, адсорбтив? Какие силы могут действовать между молекулами или ионами адсорбента и адсорбтива? Основные виды адсорбции.
4. Объясните физический смысл динамического адсорбционного равновесия. Какие воздействия могут изменять это равновесие?
5. В чём заключается и чем объясняется избирательность адсорбции на твердой поверхности? Правило Панета Фаянса для эквивалентной адсорбции.
6. Смысл теории мономолекулярной адсорбции Лэнгмюра? Уравнение и изотерма адсорбции Лэнгмюра. Их физический смысл.
7. Уравнение и кривая адсорбции Фрейндлиха. Как определяют константы, входящие в уравнение? Для каких случаев адсорбции оно применимо?
8. В чём смысл теории полимолекулярной адсорбции Поляни? Изотерма адсорбции БЭТ для полимолекулярной адсорбции (объясните ход кривой).
9. Эквивалентная адсорбция. Правило Панета-Фаянса.
10. Ионообменная адсорбция. Что такое ионообменники, какова их структура, как они различаются по основности. Применение ионообменников.
11. Будет ли происходить адсорбция ионов на частицах сульфата бария в растворе хлористого натрия? Обосновать ответ.
12. Будет ли происходить адсорбция ионов на частицах хлорида серебра в растворе хлористого калия? Ответ обосновать.
13. Будут ли обмениваться гидрокарбонат ионы на ионообменике с кар-боксильными функциональными группами? Обосновать ответ.
14. Будут ли обмениваться ионы натрия на ионообменнике с карбоксильными функциональными группами. Обосновать ответ.
15. Будут ли обмениваться ацетат ионы на ионообменнике, функциональными группами которого являются аминогруппы? Ответ обосновать.
16. Будут ли обмениваться ионы аммония на ионообменнике, функцио-нальными группами которого являются аминогруппы? Ответ обосновать.
17. Привести примеры адсорбции на твердой поверхности в организме. Объясните физиологическое значение адсорбции в каждом случае.
18. Как используется адсорбция при лечении больных? Что такое адсорбционная терапия и гемосорбция?
19. Какие группы веществ являются поверхностно-неактивными? Как и почему они влияют на поверхностное натяжение растворов?
20. Какие группы веществ являются поверхностно-активными? Как и почему они влияют на поверхностное натяжение растворов?
21. Какой вид имеют изотермы поверхностного натяжения адсорбции поверхностно-активных веществ? Есть ли между ними взаимосвязь?
22. Привести уравнения, определяющие величину адсорбции на поверхности жидкости. Указать границы их применимости.
23. Что такое поверхностная активность веществ, какие значения она может принимать, как определить её величину?
24. Какие общие черты характерны для структуры молекул ПАВ (объяснить, привести примеры)? Что такое гидрофильно-липофильный баланс (ГЛБ)?
25. Как зависит поверхностная активность ПАВ от структуры их молекул? В чем состоит правило Дюкло-Траубе? Объяснить, привести примеры.
26. Какие существуют виды ПАВ, чем они отличаются (привести примеры)?
27. Как располагаются молекулы ПАВ на поверхности жидкости? Какова структура образуемого ими адсорбционного слоя?
28. Назовите наиболее важные естественные ПАВ, действующие в организме, объясните их функции.
29. Использование ПАВ в быту, технике, в клинической практике и в фармации.
30. Как и во сколько раз изменится поверхностная активность растворённого вещества, если вместо раствора пропионовой кислоты С2Н5СООН взять раствор валериановой кислоты С4Н9СООН той же концентрации? Ответ обосновать.
31. Как и во сколько раз изменится поверхностная активность растворённого вещества, если вместо раствора масляной кислоты С3Н7СООН взять раствор уксусной кислоты СН3СООН той же концентрации? Ответ обосновать.
32. Вычислите величину поверхностного натяжения водного раствора бутанола концентрацией 0,1 моль/л при 20оС, если поверхностное натяжение раствора пропанола-1 такой же концентрации равно 65,5 . 10−3 Дж/м2.
33. Поверхностное натяжение 0,0312 М раствора пропионовой кислоты составляет 69,5 мДж/м2, 0,0625 М раствора - 67,7 мДж/м2, а поверхностные натяжения растворов масляной кислоты таких же концентраций соответственно равны 65,8 мДж/м2 и 60,4 мДж/м2. Сравните поверхностную активность кислот в водных растворах в указанном интервале концентраций и укажите выполняемость правила Дюкло-Траубе.
34. Поверхностное натяжение 0,125 М раствора метилпропанола составляет 52,8 мДж/м2, 0,25 М раствора - 44,1 мДж/м2, а поверхностные натяжения растворов метилбутанола таких же концентраций соответственно равны 47,6 мДж/м2 и 23,7 мДж/м2. Сравните поверхностную активность спиртов в водных растворах в указанном интервале концентраций и укажите выполняемость правила Дюкло-Траубе.
35. 0,04 М водный раствор масляной кислоты при 293 K имеет поверхностное натяжение 67,7 мДж/м2, а 0,08 М раствор 62,1 мДж/м2. Вычислите поверхностную активность масляной кислоты в данном интервале концентраций. Ответ: −140 мДж.л/м2.моль.
36. Вычислите величину и определите тип адсорбции масляной кислоты на границе её 0,04 М раствора с воздухом при 293 K, если поверхностное натяжене этого раствора 65,56 мДж/м2. Поверхностное натяжение воды в тех же условиях 74,01 мДж/м2. Универсальная газовая постоянная равна 8,31 кДж/моль . град. Ответ: 217,3.10−4 моль/л.
37. Поверхностное натяжение 0,12 М раствора масляной кислоты при 293 K равно 54,55 мДж/м2, а 0,16 М раствора 48,11 мДж/м2. Вычислите величину и определите тип адсорбции масляной кислоты на поверхности раствора для данного интервала концентраций. Универсальная газовая постоянная равна 8,31 кДж/моль . град. Ответ: 9,26.10−3 моль/л.
38. При уменьшении концентрации новокаина в растворе с 0,2 М до 0,15М поверхностное натяжение возросло с 6,9 . 10-2 Дж/м2 до 7,1 . 10-2Дж/м2, а в случае растворов кокаина с 6,5 . 10-2 Дж/м2 до 7 . 10-2 Дж/м2. Сравните величины адсорбции при 293 K двух веществ в данном интервале концентраций. Ответ: адсорбция кокаина 2,5 раза больше.
39. Емкость адсорбента АДБ по холестерину (предельная адсорбция) составляет 0,7 мкмоль/г. Вычислите величину адсорбции холестерина из плазмы крови, содержащей 4,8 мкмоль/мл холестерина, если константа равновесия составляет 2 мкмоль/мл. Ответ: 0,494 мкмоль/г.
40. Концентрация холестерина в плазме крови после проведения гемосорбции снизилась с 4,8 до 4,0 мкмоль/мл. Чему равна емкость данного адсорбента (адсорбция) по холестерину (в мкмоль/г), если объем плазмы равен 1 л, а масса сорбента равна 10 г? Ответ: 80 мкмоль/г.
41. Концентрация кетоновых тел, накапливаемых в крови больных сахарным диабетом в течение суток (равновесная концентрация), достигает 0,2 моль/л.
42. Какое количество кетоновых тел адсорбируется из крови при гемосорбции, если емкость адсорбента (предельная адсорбция) равна 3 . 10-3 моль/г, а константа равновесия 6 . 10-2 моль/л? Ответ: 2,3.10−3 моль/г.
43. Экспериментально установлено, что величина максимальной адсорбции пропионовой кислоты на угле составляет 3 ммоль/г, а K = 6 . 10-2 моль/л. Пользуясь уравнением Ленгмюра установите, какая масса кислоты (ММ = 74 г/моль) адсорбировалась на 1 г адсорбента из раствора, в котором установилась равновесная концентрация 0,1 моль/л? Ответ: 138 мг.
44. Рассчитайте площадь, занимаемую одной молекулой бутанола в мо-номолекулярном адсорбционном слое на поверхности раствора, если предельная величина адсорбции Гмах= 1 . 10-9 моль/см2. Ответ: 1,66.10−15 см2.
45. Определите предельную величину адсорбции бутанола на поверхности раствора, если площадь поперечного сечения его молекулы составляет 1,66 . 10-15 см2. Ответ: 1.10−9 моль/см2.
46. Найдите площадь, приходящуюся на одну молекулу олеиновой кислоты в насыщенном адсорбционном слое, если предельная величина адсорбции составляет 7,42 . 10-9 моль/см2. Ответ: 2,24.10−16 см2.
47. Определите предельную величину адсорбции масляной кислоты на поверх-
ности раствора, если площадь поперечного сечения её молекул составляет 2,22 . 10-15 см2. Ответ: 7,48.10−10 моль/см2.
48. Определите предельную величину адсорбции изопенталола на поверхности раствора, если площадь приходящаяся на одну молекулу в насыщенном адсорбционном слое составляет 2,2 . 10-15 см2. Ответ: 7,55.10−10 моль/см2.
49. Рассчитайте площадь, приходящуюся на одну молекулу анилина и толщину мономолекулярного слоя, если предельная величина адсорбции Гмах= 6 . 10-9 моль/см2, d = 1,022 г/см3, ММ = 93 г/моль. Ответ: 2,77.10−16 см2; 5,46.10−7 см.
50. Вычислите длину молекулы масляной кислоты, если площадь, занимаемая одной молекулой в поверхностном слое раствора составляет 2,22 . 10-15 см2, плотность масляной кислоты 0,96 г/см3, молярная масса 88 г/моль. Ответ: 6,86.10−8 см.
51. Вычислите длину молекулы масляной кислоты, если предельная величина адсорбции её составляет 7,48 . 10-10 моль/см2, молярная масса кислоты 88 г/моль, плотность 0,96 г/см3. Ответ: 6,86.10−8 см.
52. Рассчитайте длину молекулы бутанола, если предельная величина адсорбции его на поверхности раствора составляет 1 . 10-9 моль/см2. Молярная масса бутанола 74 г/моль, плотность 0,81 г/см3. Ответ: 9,136.10−7 см.
53. Вычислите поверхностное натяжение раствора масляной кислоты на границе с воздухом, если при вытекании из сталагмометра число капель его составило 86, а число капель воды 60. Поверхностное натяжение воды 72,56 мДж/м2. Ответ: 47,248 мДж/м2.
54. Вычислите по данным сталагмометрического исследования поверхностное натяжение этанола при 250С, если число капель воды – 32, а спирта 64. Поверхностное натяжение воды при этой температуре равно 72,56 мДж/м2. Ответ: 36,28 мДж/м2.
55. Определите поверхностную активность этилацетата по следующим данным, полученным при 298К:
С, моль/л 0,0078 0,0156 0,03120 0,06250 0,1250 0,2500 0,5000
s, мДж/м2 69,6 68,0 65,1 61,5 56,2 49,7 41,5
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
56. Определите поверхностную активность додецилсульфата натрия по следующим данным, полученным при 20оС:
С, ммоль/л 2,16 3,96 6,6 8,3 9,3 9,8 10,2 11,2
s, мДж/м2 62 54 47 43 42 41 41 41
Построить изотерму адсорбции Гиббса. s(Н2О) = 72,56 мДж/м2.
57. Пользуясь уравнением Фрейндлиха вычислите равновесную концентрацию раствора уксусной кислоты, если 1 г угля адсорбировал 3,76 ммоль её. К = 0,12; n = 0,5. Ответ: 5,6 ммоль/л.
58. По уравнению Фрейндлиха вычислите равновесную концентрацию ацетона, если 1 г угля адсорбировал 1,772 ммоль его. K = 0,1585; n = 0,5. Ответ: 3,34 ммоль/л.
59. Рассчитайте величину адсорбции уксусной кислоты на твердом адсорбенте,
если в медико-биологических исследованиях была установлена равновесная концентрация, равная 0,22 моль/л, а константы в уравнении Фрейндлиха: K = 0,1585; n = 0,5. Ответ: 7,67.10−3 моль/г.
60. Какова масса уксусной кислоты, адсорбированной 1,5 г угля, если концентрация её в растворе до адсорбции составляла 0,1 моль/л, а после адсорбции из 50 мл раствора − 0,07 моль/л? Ответ: 0,09 г.
61. Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 4,1 и 1,5 мл. Вычислите величину адсорбции. Ответ: 0,325 ммоль/г.
62. Для проведения адсорбции к 50 мл раствора уксусной кислоты внесено 2 г активированного угля. Температура опыта 25оС. Объемы 0,1 М раствора NaOH, израсходованных на титрование 20 мл растворов кислоты до и после адсорбции составили 11,2 и 4,4 мл. Вычислите величину адсорбции. Ответ: 0,85 ммоль/г.
63. В 50 мл раствора уксусной кислоты с концентрацией 0,1 моль/л поместили активированный уголь массой 2 г и взбалтывали смесь до достижения адсорбционного равновесия. После этого раствор отфильтровали. На титрование 10 мл фильтрата пошло 15 мл раствора титранта с концентрацией KOH, равной 0,05 моль/л. Вычислите величину адсорбции. Ответ: 0,625 ммоль/г.
64. В 60 мл 0,44 М раствора некоторого вещества поместили активированный уголь массой 3 г. Раствор с адсорбентом взбалтывали до установления адсорбционного равновесия, в результате чего концентрация вещества снизилась до 0,35 моль/л. Вычислите величину адсорбции. Ответ: 1,8 ммоль/г.
65. На основе каких опытов по изучению адсорбции веществ М.С.Цвет разра-ботал метод хроматографии? Для чего он применяется в настоящее время?
66. Каков общий механизм разделения смесей веществ при хроматографии? Что такое элюция?
67. Какие виды хроматографии различают по механизму взаимодействия разделяемых веществ с адсорбентом? Объясните механизм разделения веществ в каждом случае.
68. Классификация методов хроматографии по агрегатному состоянию фаз, техническому исполнению.
Дата публикования: 2015-09-18; Прочитано: 32638 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
