 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Адсорбция на границе газ- или жидкость-жидкость
|
|
При рассмотрении поведения молекул поверхностного слоя жидкости на границе с газом (см. рис.1) было показано, что находящиеся на этой поверхности молекулы обладают запасом потенциальной энергии – поверхностной энергией. С увеличением поверхности возрастает и поверхностная энергия. Поверхностная энергия возрастает и при таком процессе как дробление твердого тела в газе или жидкости, которое сопровождается увеличением поверхности раздела фаз.
Если дробление одной фазы в другой идет в изотермических условиях и при постоянном объеме, то изменение энергии поверхности равно изменению изохорно-изотермического потенциала:
F = σ∙S, (7.1)
где F– поверхностная энергия, Н∙м, или изохорно-изотермический потенциал;
σ – поверхностное натяжение, Н/м;
S– площадь поверхности, м2.
Согласно второму закону термодинамики самопроизвольно идут те процессы, при которых изохорно-изотермический потенциал – F -уменьшается. В гетерогенных системах возможным путем уменьшения F является сокращение поверхности. Так как поверхность твердых тел самопроизвольно сокращаться не может (является постоянной величиной), самопроизвольное уменьшение поверхностной энергии может быть результатом снижения поверхностного натяжения σ при поглощении молекул или растворенного вещества поверхностью твердого тела.
Явление поглощения твердым или жидким телом веществ из внешней среды называется сорбцией. Сорбция, происходящая только на поверхности тела, называется адсорбцией. Если же поглощение происходит всем объемом поглотителя, то такое явление называется абсорбцией. Силы взаимодействия адсорбента и адсорбата, определяющие адсорбцию, различны, и обычно рассматривают два крайних случая, когда адсорбция характеризуется физическими (ван-дер-ваальсовыми) либо химическими взаимодействиями.
Адсорбция может идти на поверхности раздела следующих фаз: газ-твердое тело, раствор – твердое тело, газ – раствор, жидкость - раствор. Адсорбцию выражают в молях поглощенного вещества (адсорбата) на квадратный метр поглотителя (адсорбента). Однако поверхность поглотителя найти труднее, чем его массу, поэтому часто адсорбцию выражают в моль/кг, а адсорбцию газов – в кубических метрах на килограмм.
Адсорбция газов твердыми адсорбентами. Величина адсорбции зависит от природы адсорбата и адсорбента, от температуры и от давления газа адсорбата. Зависимость адсорбции от давления газообразного вещества выражается эмпирическим уравнением Фрейндлиха:
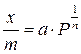 , (7.1)
, (7.1)
где х – количество адсорбата в молях или объем в м3; m – масса поглотителя (адсорбента), кг; Р – давление, Па; a и n – константы, характерные для данного процесса адсорбции (n > 1).
Так как это уравнение справедливо только при постоянной температуре, то его называют изотермой адсорбции. Константы a и n в уравнении Фрейндлиха могут быть определены графическим способом. С этой целью уравнению логарифмируют:
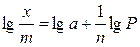 . (7.1а)
. (7.1а)
Далее в логарифмических координатах строят график изотермы адсорбции: по оси абсцисс откладывают логарифмы равновесных давлений lg P, а по оси ординат – логарифмы адсорбции lg х/m. Изотерма представляет собой прямую линию (рис. 4).
Если же эту прямую продолжить до пересечения ее с осью ординат, то она на ней отсечет отрезок, равный lg a. Если lg P = 0, то  . Тангенс же угла наклона этой прямой к оси абсцисс есть значение 1/ n.
. Тангенс же угла наклона этой прямой к оси абсцисс есть значение 1/ n.
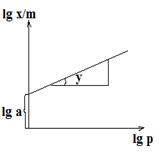
Рис. 4. Логарифмическая изотерма адсорбции Фрейндлиха
Однако уравнение Фрейндлиха неприменимо в области малых и больших давлений адсорбируемого вещества. Сравнительно удовлетворительную количественную характеристику адсорбции, как при низких, так и при высоких давлениях адсорбируемого вещества дает уравнение изотермы адсорбции Лэнгмюра, выведенное на основании молекулярно-кинетической теории:
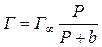 , (7.2)
, (7.2)
где Г – количество адсорбируемого вещества (моль) единицей поверхности поглотителя; Г ∞ – количество адсорбируемого вещества в молях при полном насыщении единицы поверхности; Р – давление; b – константа адсорбционного равновесия.
Для определения Г ∞ и b графическим способом необходимо уравнение Лэнгмюра привести к линейному виду. С этой целью единицу делят на обе части уравнения:
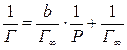 . (7.2а)
. (7.2а)
Если на оси абсцисс отложить величину 1/ Р, а на оси ординат 1/ Г, то на графике получится прямая линия (рис. 7.2). Из преобразованного уравнения Лэнгмюра следует, что если 1/ Р = 0, то 1/ Г = 1/ Г ∞.
Следовательно, если прямую линию графика продолжить до пересечения с осью ординат, то отрезок ОА на оси ординат будет равен 1/ Г ∞. Тангенс угла наклона этой прямой к оси абсцисс есть значение b / Г ∞∙tgφ = b / Г ∞ = ВС/АС.
Определив графическим методом константу Г ∞, константу b теперь можно также рассчитать из уравнения Лэнгмюра.

Рис. 5. Графическое определение констант Г ∞ и b, входящих
в уравнение адсорбции Лэнгмюра.
Капиллярная конденсация. Капиллярная конденсация в самом начале может рассматриваться как адсорбционный процесс. Однако при сорбции паров на твердых пористых адсорбентах процесс может перейти в капиллярную конденсацию. Адсорбируясь на стенках пор (капилляров) сорбента, пар конденсируется в жидкость. Если жидкость хорошо смачивает поверхность твердого тела, самые тонкие капилляры заполняются жидкостью, образующей вогнутый мениск. Давление насыщенного пара над вогнутым мениском всегда меньше давления пара над плоской поверхностью жидкости и поэтому пар начнет конденсироваться над вогнутым мениском и капилляры заполняются жидкостью.
Адсорбция из растворов на твердом адсорбенте – процесс более сложный, чем адсорбция газов. Растворы, как минимум, являются двухкомпонентными системами, состоящими из растворенного вещества и растворителя. При адсорбции твердым телом из раствора в уравнениях Фрейндлиха и Лэнгмюра давление Р заменяют величиной равновесной молярной концентрации С:
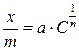 ; (7.1б)
; (7.1б)
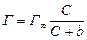 . (7.2б)
. (7.2б)
Если же адсорбция какого-либо вещества происходит на поверхности раствора, то это приводит к изменению поверхностного натяжения. Количественное соотношение между величиной адсорбции и изменением поверхностного натяжения с концентрацией раствора определяется уравнением Гиббса:
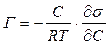 , (7.3)
, (7.3)
где Г – адсорбция – избыток растворенного вещества, моль/м2;
С – молярная концентрация растворенного вещества в растворе, моль/л;
R – газовая постоянная, Дж/(моль∙К); Т – температура, К; σ – поверхностное натяжение, Н/м.
Для приближенных расчетов 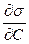 можно заменить на выражение:
можно заменить на выражение:
 .
.
Тогда
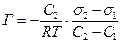 . (7.4)
. (7.4)
Из уравнения следует, что если с увеличением концентрации растворенного вещества поверхностное натяжение уменьшается, то адсорбция положительна. Если же растворенное вещество поверхностное натяжение повышает, то адсорбция отрицательная.
Адсорбция из растворов определяется не только силами взаимодействия между молекулами растворенного вещества и адсорбента, но и взаимодействием растворитель – адсорбент и растворитель – растворенное вещество. Если растворенное вещество – электролит, то процесс адсорбции осложняется еще и тем, что в этом случае адсорбируются ионы, несущие электрический заряд.
Большое влияние на адсорбцию из растворов оказывают природа адсорбента, природа растворителя и природа растворенного вещества.
Природа адсорбента. Все адсорбенты можно разбить на два типа: гидрофильные, которые хорошо смачиваются водой (песок, глина, пористое стекло) и гидрофобные, которые не смачиваются водой, но смачиваются неполярными органическими жидкостями (активированный уголь, тальк). Большое значение имеет пористость адсорбента: чем меньше поры, тем больше поверхность сорбента и его адсорбционная активность.
Природа растворителя. Жидкости, хорошо смачивающие поверхность твердых тел, обычно имеют небольшое поверхностное натяжение. Из всех применяемых растворителей вода имеет самое большое поверхностное натяжение; поверхностное натяжение органических растворителей значительно ниже. Поэтому, как правило, адсорбция лучше идет из водных растворов и хуже из растворов с органическими растворителями.
Природа растворенного вещества. В общем случае можно сказать, что гидрофобные адсорбенты должны лучше адсорбировать органические дифильные (состоящие из двух частей: полярной и неполярной) вещества из водных растворов; гидрофильные адсорбенты должны лучше адсорбировать их из неполярных или слабополярных растворителей.
При адсорбции электролитов твердыми адсорбентами наблюдается избирательная адсорбция: преимущественная адсорбция катиона или аниона. Величина избирательной адсорбции определяется следующими факторами: природой адсорбента, природой ионов, их валентностью, радиусом и степенью гидратации. Чем больше валентность иона, тем лучше его адсорбция; из ионов одинаковой валентности лучше адсорбируется ион наибольшего радиуса; наличие гидратной оболочки препятствует адсорбции.
Адсорбция на границе раствор – газ. В случае данного вида адсорбции поверхностная энергия самопроизвольно уменьшается благодаря снижению поверхностного натяжения. Поверхностное натяжение раствора σ почти всегда отличается от поверхностного натяжения чистого растворителя σ0. Вещества, которые уменьшают поверхностное натяжение растворителя, называются поверхностно-активными веществами (ПАВ).
Дата публикования: 2015-07-22; Прочитано: 1718 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
