 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические характеристики основных стадий процесса
|
|
Сырьем для получения трифторида алюминия являются очищенная фтороводородная кислота и гидроксид алюминия.
Процесс получения трифторида алюминия основан на нейтрализации фтороводородной кислоты гидроксидом алюминия по уравнению:
Аl(ОН)3+3НF= А1F3+3Н2O+Q(3.1)
где Q — теплота реакции образования трифторида алюминия, равная 329 ккал/моль.
В очищенной фтороводородной кислоте и пульпе гидроксида алюминия присутствуют примеси Nа2SiF6, NаF, SiO2, Fe2O3, Na2O, К2О, которые в процессе варки частично переходят в готовый продукт в виде криолита и других соединений, тем самым снижается содержание основного вещества — трифторида алюминия. Имеющаяся во фтороводородной кислоте H2SO4 реагирует с гидроксидом алюминия по реакции:
2Аl(ОН)3+3H2SO4= А12(SO4)3+6Н2O (3.2)
Так как, образующиеся по реакциям соли — А12(SO4)3, Al2(SiF6)3 — хорошо растворимы в воде, то, взаимодействуя с НF, образуются трифторид алюминия, серная и кремнефтороводородная кислоты:
А12(SO4)3 + 6НF = 2А1F3+З H2SO4 (3.3)
Al2(SiF6)3 +6НF = 2А1F3+ЗH2SiF6 (3.4)
При этом H2SO4, H2SiF6 и другие растворимые соединения частично удаляются с маточным раствором в процессе фильтрования пульпы трифторида алюминия.
Основная реакция (3.1) осложнена взаимодействием образующегося А1F3, с гидроксидом алюминия, которое с учетом комплексообразования в растворах фторида алюминия протекает в две стадии:
1) гидролиз фторида алюминия в растворе:
2А1F3+Н2O=А1F2OH + HAlF4 (3.5)
2) нейтрализация образующейся фторалюминиевой кислоты Аl(ОН)3:
3HAlF4 + Аl(ОН)3 = 4А1F3 + 3Н2O (3.6)
Лимитирующей стадией процесса является гидролиз А1F3. Увеличение температуры реакционной среды ведет к разрушению гидратных оболочек, облегчению образования активированного комплекса 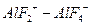 и повышению скорости реакции.
и повышению скорости реакции.
Равновесие реакции гидролиза А1F3, смещается вправо вследствие выпадения нерастворимого осадка А1(ОН)F2 и взаимодействия образующейся кислоты с Аl(ОН)3.Вследствие равенства скоростей данных реакций рН сохраняется постоянной и равна 4,6.
Стабильность рН обеспечивает постоянство относительной концентрации А1F2 АlF4 за счет диссоциации А1F3 по реакции
2А1F3 = 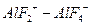 (3.7)
(3.7)
Раствор H2SO4 значительно медленнее реагирует с. Аl(ОН)3. Скорость нейтрализации H2SO4 значительно повышается присутствии алюминийфторидных комплексов в растворе. Это обусловлено одновременным протеканием реакций:
2(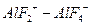 ) + H2SO4 = 2HAlF4 + (AlF2)2SO4 (3.8)
) + H2SO4 = 2HAlF4 + (AlF2)2SO4 (3.8)
Образующаяся фторалюминиевая кислота быстро взаимодействует с Аl(ОН)3 по реакции (3.8).
При повышении рН ускоряются реакции гидролиза (3.5) и (3.9).
(AlF2)2SO4 + Н2O = А1(ОН)F2 + H2SO4 (3.9)
За счет реакции (3.9) в растворе накапливается сильная H2SO4, которая медленно взаимодействует с Аl(ОН)3 в отсутствии комплекса 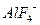 , поэтому величина рН раствора снижается. Процесс извлечения фтора и алюминия из раствора замедляется. Большая остаточная концентрация F и Al в растворах, содержащих H2SO4 связана, очевидно, с образованием фторсульфатных комплексов алюминия в виде А1FSO2 и (AlF2)2SO4.
, поэтому величина рН раствора снижается. Процесс извлечения фтора и алюминия из раствора замедляется. Большая остаточная концентрация F и Al в растворах, содержащих H2SO4 связана, очевидно, с образованием фторсульфатных комплексов алюминия в виде А1FSO2 и (AlF2)2SO4.
В результате взаимодействия фтороводородной кислоты с гидроксидом алюминия образуются относительно стабильные пересыщенные растворы трифторида алюминия, хотя растворимость кристаллического А1F3 при 25°С составляет 0,5 %мас.
Стойкость этих растворов объясняется значительной гидратацией молекул А1F3 в водных растворах и уменьшается с повышением концентрации и температуры исходных растворов.
На скорость кристаллизации влияет интенсивность перемешивания, концентрация раствора, присутствие затравочных кристаллов.
Из растворов трифторида алюминия при температуре от 85 до 90°С в твердую фазу выделяется устойчивая модификация AlF3·3H2O.На физико-химические свойства осадка AlF3·3H2O влияют, присутствие гидроксида алюминия и величина кислотности пересыщенного раствора AlF3. Для получения более крупных кристаллов необходимо поддерживать общую остаточную кислотность в растворе трифторида алюминия от 0,1 до 0,4 %мас. HF, время загрузки алюминийсодержащего материала должно быть минимально.
Варка и кристаллизация трифторида алюминия осуществляется в реакторах периодического действия и подразделяется на три этапа:
1 этап: Производится набор фтороводородной кислоты в реактор и промешивается (от 15 до 20 мин.) с целью растворение оставшегося от предыдущей варки трифторида алюминия для улучшения последующего кристаллообразования.
2 этап: Из репульпаторов по кольцевому трубопроводу производится подача пульпы гидроксида алюминия (от 15 до 20 мин.) в реакторы, в результате чего происходит бурная реакция нейтрализации фтороводородной кислоты до образования пересыщенного раствора трифторида алюминия с остаточной кислотностью от 3 до 6 г/л.
Процесс образования трифторида алюминия происходит с выделением тепла, при этом температура реакционной массы повышается от 85 до 95°С, что способствует успешному окончанию реакции.
Во избежание сильного вспенивания и выбросов реакционной массы необходимо вести равномерную загрузку пульпы гидроксида алюминия при работающей системе газоочистки.
3 этап: Кристаллизация трифторида алюминия происходит из пересыщенного раствора в течении 2,0-2,5 часов при непрерывном перемешивании с образованием кристаллов AlF3·3H2O. Процесс кристаллизации трифторида алюминия сопровождается выделением тепла, за счет которого в реакторе поддерживается температура  .
.
Процесс сушки заключается в удалении влаги из материала с целью улучшения качества продукта, предохранения его от порчи и слеживаемости, снижения веса, придания транспортабельности.
На сушку поступает паста кристаллогидрата трифторида алюминия, содержащая как свободную, так и связанную в кристаллической решетку воду. Процесс сушки гидратированного трифторида алюминия проводится конвективно-кондуктивным способом, при этом, на начальной стадии, в зоне конвективной сушки (перенос теплоты, обусловленный движением среды) процесс дегидратации AlF3·3H2O следует вести при температуре не более 300°С с образованием полугидрата, т.е AlF3·0,5H2O по реакции:
2 AlF3·3H2O = AlF3·0,5H2O + 2,5H2O (3.10)
Для полного обезвоживания трифторида алюминия его необходимо прокаливать при 400-550°С в аппарате с кондуктивным способом подвода тепла, т.е в тепловом агрегате, где теплообмен между продуктом и теплоносителем происходит через разделяющую их металлическую стенку.
В ходе одностадийной сушки трифторида алюминия проходит побочная реакция, что не позволяет получить продукт с высоким содержанием основного вещества:
2 AlF3·0,5H2O +2H2O = Al2O3 + 6HF (3.11)
Увеличение парциального давления паров HF над продуктом достигается за счет специальной конструкции теплового агрегата (2-я стадия сушки), в котором процесс дегидратации полугидрата происходит непрерывно в замкнутом пространстве и при повышенной температуре, с получением качественного продукта по реакции:
AlF3·0,5H2O = AlF3 + 0,5H2O (3.12)
В указанных условиях обеспечивается получение мелкокристаллического трифторида алюминия.
Производство тонкоизмельченного порошка приводит к его значительным потерям (до 15-25 %мас. по различным источникам) в производстве металлического алюминия. Устранение этого недостатка затруднено плохой брикетируемостью безводного AlF3·хH2O, получаемого традиционными методами.
Дата публикования: 2015-07-22; Прочитано: 546 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
