 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы получения трифторида алюминия
|
|
Все многообразие способов получения трифторида алюминия прежде всего можно поделить на две основные группы, различающиеся по виду фторсодержащегося сырья. Основными источниками фтора являются плавиковый шпат, в котором фтор находится в виде СаF2 и фторапатит, из которого фтор извлекается в виде SiF4, входящего в состав отходящих газов при сернокислотном разложении фторапатита.
Способы, основанные на переработке флюорита, различаются фазовым состоянием фтороводорода. «Сухие» методы предусматривают использование газообразного НF, в свою очередь, «мокрые» гидрохимические методы базируются на фтороводородной кислоте и различаются степенью чистоты последней.
Способы, основанные на переработке тетрафторида кремния, различаются методом извлечения фтора и могут быть представлены тремя группами:
— высокотемпературная обработка водяным паром с получением НF;
— абсорбция SiF4 водой с получением Н2SiF6;
— абсорбция SiF4 аммиаком с получением NH4 F.
«Сухой» метод заключается в непосредственном взаимодействии газообразного НF с порошкообразным А12О3. «Сухой» метод более удобен для крупномасштабного производства и постепенно приобретает все большее значение.
«Сухой» метод позволяет получать от 4,0 до 5,0 т/ч продукта при работе по непрерывной схеме. По этому методу обезвоживают А1(ОН)3 и проводят реакцию образующегося А12O3 с НF при одновременной отгонке воды при температуре от 400 до 600 °С по реакциям:
2А1(ОН)з = А12Oз + 3Н2 O (2.1)
6НF + А120з = 2А1F3 + 3Н20 (2.2)
Достоинствами сухого адсорбционного метода являются:
— устранение водооборотного хозяйства;
— исключение потерь за счет каплеуноса;
— уменьшение коррозии аппаратуры.
При «сухом» методе обеспечивается улавливание и возврат в производство от 98 до 99% мас. фторидов.
Более широкое практическое применение имеет "мокрый" метод, когда реакция проводится в водном растворе:
3НF+Аl(ОН)3 = 3А1FЗ + 3Н2O (2.3)
При осуществлении «мокрого» метода к 15 %мас. водному раствору НF добавляют Аl(ОН)3 он постепенно растворяется, образуя кристаллы А1F3*3Н20, которые отделяют и сушат при температуре 600 °С.
Вторая группа методов предполагает использование фтора, содержащегося в фосфатных рудах в концентрации от 3 до 5 %мас. От 20 до 30 %мас. этого фтора уходит с отходящими газами в процессе получения фосфорной кислоты сернокислотным разложением фторапатита. Количество фтора, переходящего в газовую фазу, зависит от температурного режима и в промышленно внедренных способах максимально в полугидратном процессе получения экстракционной фосфорной кислоты. Отходящие газы в данном процессе содержат фтор в виде тетрафторида кремния — SlF4. Существует метод получения НF из этих газов реакцией с водяным паром при температуре около 800°С с последующим взаимодействием НF с А1(ОН)3 по реакциям:
SiF3 + 2Н2 O= 4НF + SiO2(2.4)
3НF + Аl(ОН)3= А1F3*3Н2O. (2.5)
По другому методу отходящие газы абсорбируют водой с переводом SiF4 в кремнефтористоводородную кислоту.
В одном из способов H2SiF6 при взаимодействии с А1(ОН)3 дает трифторид алюминия. Это можно описать уравнениями:
3SiF4 + 2H2O =2H2SiF6 + 3SiO2 (2.6)
Н2SiF6 + 2А1(ОН)з+2Н2O=2А1Fз*3Н2 O + SiO2 (2.7)
Более рациональным является кислотный способ, разработанный УНИХИМом, по которому вначале получают из Н2SiF6 трифторид алюминия, а затем криолит.
Для этого в полученной из фтористых газов кремнефтористоводородной кислоте, содержащей от 12 до 13%мас. H2SiF6 и кремнегель, нагретой до 85 "С, растворяют в течение 15-ти минут при перемешивании гидрат окиси алюминия по реакции:
Н2SiF6 + 2А1(ОН)з = 2А1Fз + SiO2* 2Н2O+ Н2O (2.8)
Это взаимодействие идет в две стадии:
3H2SiF6 +2Al(OH)3 =Al2(SiF)6+H2O (2.8.1)
Al2(SiF)6+12H2O =2AlF3+ 3SiO2*2H2O+12HF (2.8.2)
Образующийся HF не выделяется, а нейтрализуется гидроксидом алюминия:
12НF+4А1(ОН)з = 4А1Fз+12H2O (2.9)
Образование в качестве промежуточного продукта кремнефторида алюминия завершается при температуре от 50 до 90 "С в течение 1-3 минут, разложение же его в растворе и образование А1F3 идет в десятки раз медленнее. Благодаря способности А1F3 образовывать стойкие пересыщенные растворы, из них возможно выделить SiO2, и выпустить его в виде побочного продукта — активного наполнителя. Для получения достаточно хорошо фильтрующегося осадка кремнегеля свободная кислотность пульпы после завершения реакции должна быть около 5 г/л H2SiF6. Активность кремнегеля возрастает с увеличением скорости введения гидроксида алюминия и интенсивности перемешивания. При переработке кислоты с концентрацией до 8%мас. H2SiF6 может быть получен аморфный кремнезем с малым содержанием кристаллической фазы с очень развитой удельной поверхностью, около 50 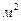 /г. Получение такого кремнезема из кислоты большей концентрации затруднительно. Содержание в кремнеземе до 0,3%мас. фтора и до 15%мас. Al(OH)3 существенно не влияет на активные свойства кремнегеля.
/г. Получение такого кремнезема из кислоты большей концентрации затруднительно. Содержание в кремнеземе до 0,3%мас. фтора и до 15%мас. Al(OH)3 существенно не влияет на активные свойства кремнегеля.
Раствор, получаемый после отделения фильтрацией кремнегеля, содержит до 14 % мас. AlF3 и остается пересыщенным. При низкой температуре он не кристаллизуется в течение длительного времени. Для кристаллизации А1F3 ·3Н2O в раствор вводят затравку и перемешивают при  в течение четырех часов. Первые кристаллы выделяющегося фторида представляют собой твердый раствор А1F3·3Н2O и А1F3*3,5Н2О, лишь затем образуется устойчивый тригидрат. Его кристаллизация ускоряется с увеличением концентрации исходного раствора. Нагревая тригидрат фторида алюминия до
в течение четырех часов. Первые кристаллы выделяющегося фторида представляют собой твердый раствор А1F3·3Н2O и А1F3*3,5Н2О, лишь затем образуется устойчивый тригидрат. Его кристаллизация ускоряется с увеличением концентрации исходного раствора. Нагревая тригидрат фторида алюминия до 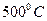 , получают безводный фтористый алюминий. При температуре выше
, получают безводный фтористый алюминий. При температуре выше 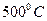 начинается заметный гидролиз А1F3 с потерей HF.
начинается заметный гидролиз А1F3 с потерей HF.
Известно, что себестоимость фторида алюминия на предприятиях по производству минеральных удобрений примерно в 1,2 (а криолита в 1,7) раза ниже, чем при производстве этих солей из плавикового шпата. Окупаемость капитальных вложений ниже в 2-3 раза. Затраты на сырье в производстве фторида алюминия составляют около 40 %мас., топливо и энергозатраты — 10 %мас., расходы на содержание и эксплуатацию оборудования — около 25 %мас.. На производство 1 тонны фторида алюминия и криолита затрачивается соответственно от 0,75 до 0,85 т и от 0,6 до 0,7 т кремнефтористоводородной кислоты в пересчете на 100 %мас. F.
Основными направлениями по совершенствованию методов переработки кремнефтористоводородной кислоты на фтористые соединения являются:
— создание непрерывного процесса производства фторида алюминия в сочетании с кондуктивным методом сушки продукта, что позволит снизить энергозатраты и повысить его качество;
— разработка и внедрение методов гранулирования фторида алюминия;
— сокращение потерь фтора с маточными растворами производства фтористых солей путем внедрения замкнутых схем водооборота;
— решение проблем утилизации кремнегеля, образующегося при производстве фторида алюминия.
К сожалению, до настоящего времени переработка фосфатного сырья с получением минеральных удобрений сопровождается сравнительно низким уровнем использования фтора. Это обстоятельство не является следствием отсутствия методов его извлечения, а обусловлено нерациональным подходом к данной проблеме, не учитывающим, что уменьшение безвозвратных потерь фтора с минеральными удобрениями может в гораздо большей степени способствовать сохранению собственных ресурсов плавикового шпата и уменьшению объемов флюоритового концентрата, закупаемого за рубежом. Кроме того, нет уверенности в том, что фтор, входящий в состав минеральных удобрений, не оказывает отрицательного влияния на человека и окружающую среду.
Представляет интерес улавливание фтора из отходящих газов с получением фтористого аммония, легко перерабатываемого в другие фтористые соединения. Причем, получаемые аммиачным методом фтористые соли содержат меньшее количество примесей. Кроме того, этот метод позволяет избежать применения соды, использование которой неизбежно приводит к загрязнению маточных растворов и сточных вод соединениями натрия и значительно осложняет их обезвреживание с целью выведения части сточных вод из водооборотного цикла. С другой стороны, в этом методе не будет выхода фтора в виде менее ценного кремнефтористого натрия, являющегося побочным продуктом при получении фтористых солей сернокислотным разложением плавикового шпата. Аммиачный метод позволяет с успехом перерабатывать на только отходящие газы, но и низкосортный необогащенный шпат, содержащий от 40 до 50%мас. CaF2, с предварительным получением из него кремнефтористоводородной кислоты. Повышенное содержание кремнезема в шпате благоприятно, так как дает возможность увеличить выход побочного продукта — белой сажи.
При нейтрализации аммиаком или аммиачной водой кремнефтористоводородной кислоты, полученной из отходящих фтористых газов, а также неочищенной плавиковой кислоты из плавикового шпата, идут следующие реакции:
НF+NHз = NH4F (2.10)
Н2SiF6+2NH3= (NH4)2 SiF6 (2.11)
(NH4)2 SiF6 +4NH3+(n+2)H2O=6NH4F+SiO2 ·nH2O (2.12)
При улавливании фтористых газов аммиачной водой протекает реакция:
SiF4 +4NH4OH + H2O = 4NH4 F + SiO2*nН2O (2.13)
При абсорбции SiF4 6-10 %мас. растворами NH4OH образуется кремниевая кислота, которая хорошо отстаивается и сравнительно легко отделяется от жидкости. Более слабыеили более крепкие растворы аммиака дают или хлопьевидный труднофильтрующий, или студневидный осадок.
Осадок аморфной кремниевой кислотыпосле промывки, сушки и разрыхления выпускается в виде побочного продукта — белой сажи. Чистые растворы фторида аммония перерабатываются на различные фтористые соли.
Трифторид алюминия может быть получен нагреванием раствора фторида аммония с гидроокисью алюминия в течение 6-8 часов. При этом осаждается легко фильтрующий аммониевый криолит (NH4)3AlF6 или 3NH4F*AlF3
За счет диссоциации NH4F и удаления NH3 в растворе образуется бифторид аммония и протекает реакция:
3NH4F•HF2+Al(OH)3 = (NH4)3AlF6+3H2O (2.14)
Осадок отфильтровывают и прокаливают при температуре  , при этом происходит разложение комплексной соли с образованием А1F3. Выделяющиеся газы (NH3+НF) могут быть уловлены и возвращены в производство.
, при этом происходит разложение комплексной соли с образованием А1F3. Выделяющиеся газы (NH3+НF) могут быть уловлены и возвращены в производство.
Можно получать фторид алюминия при нагревании окиси алюминия с бифторидом аммония выше 130 °С по реакции:
А12O3 +3NH4HF2=2А1F3 + 3NHз +3H2O (2.15)
которая идет в две стадии:
А12O3+6NH4HF2=2А1F3+6NH4F + 3H2O (2.15.1)
причем в газовую фазу выделяется водяной пар и небольшое количество NH3.
При дальнейшем нагревании окись алюминия реагирует с фторидом аммония:
А12O3 + 6NH4F=2А1F3+3NHз+3H2O (2.15.2)
В качестве побочных промежуточных продуктов образуется аммониевый криолит (NH4)3AlF6 и комплексная соль NH4AlF4 которые при температуре свыше 440 °С полностью разлагаются. При этом в газовую фазу удаляется некоторое количество NH4F
Дата публикования: 2015-07-22; Прочитано: 860 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
