 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Глинозёмды электролиздеу
|
|
5.4.1 Криолит алу
Алюминиді электролиздеуге арналған электролит үш негізгі компоненттерден тұрады: криолиттен 3NaF·AlF3 немесе Na3AlF6, фторлы натриден NaF және фторлы алюминиден AlF3.
Электролит негізінен криолиттен тұрады. Бұл минералдың шикізат көздері аз, алюминий өндірісін криолитпен қамтамасыз ете алмайды. Сондықтан криолит қолдан жасалады. Криолит алу үшін табиғи минерал флюорит (дала шпаты) CaF2 қолданылады. Дала шпатынан криолитті екі әдіспен алуға болады: қышқылдық немесе сілтілік әдіспен. Сілтілік әдіс кең қолданыс таппады. Сондықтан қазір криолитті негізінен қышқылдық әдіспен алады.
Бұл әдіс бойынша флюоритті майдалайды, флотациялай байытады да, 2000С температурада мықты күкірт қышқылымен өңдейді. Нәтижесінде келесі химиялық реакция жүреді:
CaF2 + H2SO4 = CaSO4 + 2HF (5.29)
Реакция жүрген кезде газ түріндегі фторлы сутек бөлінеді. Дала шпатындағы кремнезем фторлы сутекпен әрекеттескенде ұшқыш қосылыс SiF4 түзіледі:
SiO2 + 4HF = SiF4 + 2H2O (5.30)
Түзілетін HF және SiF4 тұратын газдардың қоспасын суға сіңіреді, нәтижесінде
SiF4 + 2HF = H2SiF6 (5.31)
реакциясы бойынша түзілетін кремнифторлы қышқылмен H2SiF6 ластанған балқытқыш қышқыл алынады.
Ластанған балқытқыш қышқыл оған сода қосып кремнисіздендіріледі. Сода кремнефторлы қышқылмен әрекеттесіп, ерігіштігі аз кремнефторлы натрий Na2SiF6 қосылысын түзеді:
H2SiF6 + Na2CO3 = Na2SiF6 + H2O + CO2 (5.32)
Na2SiF6 тұзының тұнбасы сұзіледі, ал кремниден тазарған ерітіндіні фторлы алюминий қышқылын алу үшін алюминий гидрооксидінің стехиометриялық мөлшерімен өңдейді:
6HF + Al(OH)3 = H2AlF6 + 3H2O (5.33)
Алынған фторлы алюминий қышқылының ерітіндісін криолит алу үшін содамен өңдейді:
2H2AlF6 + 3Na2CO3 = 2Na3AlF6 + СО2 + 2Н2О (5.34)
Криолит суда ерімейді де тұнбаға түседі. Криолиттің тұнбасын сүзіп алып кептіреді.
Фторлы алюминиді балқытқыш қышқылды артық Al(OH)3 пен бейтараптау арқылы алады:
3HF + Al(OH)3 = AlF3 + 3H2O (5.35)
Содамен балқытқыш қышқылға әсер ету арқылы фторлы натрий алынады:
2HF + Na2CO3 = 2NaF + CO2 + H2O (5.36)
5.4.2 Криолиті – глинозёмды балқыманың физика-химиялық қасиеттері
Алюминий алу үшін криолиті – глинозёмды балқыма қолданылады, ол келесі талаптарға сай болу керек:
- онда алюминиге қарағанда электртерістігі артық метал болмау керек;
- глиноземды жақсы ерітуі керек;
- жеңіл балқуы керек;
- сүйық алюминий ауадағы оттегімен қатынаспау үшін балқыманың тығыздығы алюминидің тығыздығынан кем болу керек;
- сүйық кезінде жақсы аққыш болу керек;
- көміртекті шегендеумен, анодпен және катодпен әрекеттеспеу керек;
- электрөткізгіштігі жеткілікті жоғары болу керек;
- гигроскопиялы болмау керек;
- электролиз үрдісі температурасы кезінде ұшқыштығы аз болу керек.
Бұл талаптарға, құрамында 3-5% СаF2, 4-5% MgCl2, 1,3 -8% Al2O3 бар, криолитті балқыма сай келеді.
Балқыма құрамының нрегізгі сипаттамаларының бірі криолиттік қатынас, ол балқымадағы 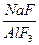 молярлық қатынасы. Таза криолитте бұл қатынаы 3-ке тең. Мұндай балқыма бейтарап деп саналады. Егер криолиттік қатынас
молярлық қатынасы. Таза криолитте бұл қатынаы 3-ке тең. Мұндай балқыма бейтарап деп саналады. Егер криолиттік қатынас 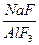 < 3 болса, балқыма қышқыл, ал
< 3 болса, балқыма қышқыл, ал 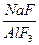 > 3 болса, балқыма сілтілік деп саналады. Өндірістік электролизерлерде криолиттік қатынас 2,6-2,8 аралығында ұсталады.
> 3 болса, балқыма сілтілік деп саналады. Өндірістік электролизерлерде криолиттік қатынас 2,6-2,8 аралығында ұсталады.
Криолит пен глиноземде үнемі болатын қоспалар Nа2O, H2O, CaO және SiO2 балқымадағы криолитті ыдыратып, криолиттік қатынасты жоғарылатады:
2Na3AlF6 + 3Na2O = Al2O3 + 12NaF (5.37)
2Na3AlF6 + 3CaO = Al2O3 + 3CaF2 +6NaF (5.38)
4Na3AlF6 + 3SiO2 = Al2O3 + 12NaF + 3SiF4 (5.39)
2Na3AlF6 + 3H2O = Al2O3 + 6NaF + 6HF (5.40)
Бұл жағдайда криолиттік қатынасты азайту үшін балқымаға AlF3 қосады. Басқа жағдайларда, мысалы былаудың көмірлі шегені NaF-ды сіңірсе, криолиттік қатынас төмендейді. Бұл кезде криолиттік қатынасты керекті шамада ұстап тұру үшін балқымаға NaF қосады. Сонымен фторлы натрий мен фторлы алюминий балқымада криолиттік қатынасты реттеу үшін қажет.
Таза криолиттің балқу температурасы 10000С. Балқымаға CaF2 және MgF2 қосқанда оның балқу температурасы төмендейді. Сондықтан алюминиді электролиздеу үрдісін 930-9500С температурада жүргізеді.
Балқымада еріген түрдегі Al2O3 электролиз үрдісін көп жеңілдетеді. Криолитті-кремнеземды балқымада глиноземнің еру мөлшері глиноземның еруіне қүрделі жолмен әсер ететін кролиттік қатынасқа байланысты. Криолиттік қатынасты 13-ке дейін көтергенде глиноземның ерігіштігі артады. Ал одан жоғары көтеру балқымада глиноземның ерігіштігін азайтады.
Балқымаға СaF2 және MgF2 қосқанды глиноземның ерігіштігі азаяды. Сонымен қатар олар глиноземның еру жылдамдығын да азайтады. Сондықтан олардың жалпы мөлшері 10% дан аспау керек. Бұл жағдай балқыманың балқу температурасын төмендетіп, глиноземның ерігіштігін жеткілікті жоғары деңгейде болуын қамтамасыз етеді. Өндірісте балқымадағы глиноземнің мөлшерін 8% шегінде ұстайды.
Барлық компоненттердің ішінде криолиттің тұтқырлығы ең жоғары. Балқымаға CaF2 және MgF2 қосу оның тұтқырлығын арттырады. Бірақ балқыманың тұтқырлығының өзгеруіне глиноземның әсері жоғары. 10000С температурада балқымаға 10% Al2O3 қосқанда оның тұтқырлығы таза криолиттің тұтқырлығымен салыстырғанда 23% артады. 10000С температурада өндірістік электролиттердің тұтқырлығы (3,25-3,4)·10-3 Па·с (3,25-3,40 спз) болады.
5.4.3 Беттік тартылу
Глиноземды-криолитті балқымаларды электролиздегенде төрт шекаралық беттер, яғни төрт әртүрлі беттік тартылу орын алады. (5.10-шы сурет).

5.10-шы сурет Алюминий электролизеріндегі беттік тартылу түрлері.
Беттік тартылудың өлшемі шеттік сулану бұрышы болады (5.11-ші сурет).

5.11-ші сурет Қатты фаза-балқыма-газ шекарасында суланудың шеттік бұрышы.
Егер сулану бұрышы 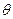 < 90о болса, беттік тартылу аз болады да, қатты фаза балқымамен жақсы суланады.
< 90о болса, беттік тартылу аз болады да, қатты фаза балқымамен жақсы суланады.
Егер сулану бұрышы > 90о болса, беттік тартылу ұлкен болады да, қатты бет балқымамен жаман суланады.
Алюминидің беттік тартылуы жоғары, сондықтан балқыма катодтың бетін нашар суландырады.
Криолитті-глиноземды электролиттің беттік тартылуы төмен, сондықтан электролизердің графитті шегенін және анодты жақсы суландырады. Ол метал алюминидің қабатының астына да өте алады.
AlF3, MgF2 және CaF2 электролиттің және балқыма-алюминий шекарасында беттік тартылуды төмендетеді, ал Al2O3 және NaF керісінше жоғарылатады.
5.4.4 Криолитті-глиноземды балқыманың компоненттерінің ыдырау кернеулігі
Электролиттің ыдырау кернеулігі деп электролиз байқалатын жылдамдықпен басталатын электродтар арасындағы кернеуді айтады. Ыдырау кернеулігі электролиз кезіндегі электр энергиясының шығынын айқындайды.
Электролиздің ақырғы нәтижесі глиноземның металдық алюминий мен оттегіне ыдырауы:
Al2O3 = 2Al + 1,5O2 (5.41)
Глиноземның ыдырау кернеулігінің мөлшері анод материалының түріне байланысты. Егер анод инертті болса, оттегі онымен әрекеттеспегенде ыдырау кернеулігінің мөлшері Al2O3-тің элементтерден түзілу реакциясы кезінде Гиббс энегриясының өзгеруімен анықталады, %:
Uы.к. = - 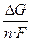 = -
= -  = 2,72 В (5.42)
= 2,72 В (5.42)
мұнда ΔG  - Al2O3 түзілу кезінде Гиббс энергисының өзгеруі,кДж;
- Al2O3 түзілу кезінде Гиббс энергисының өзгеруі,кДж;
z = 6 – реакцияға қатысушы электрондар саны;
F = 96500 –Фарадей саны, Кл.
- 1576·103 – 298 К температурада Гиббс энергиясының өзгеруі, Дж.
Алюминий электролизінде анод ретінде көміртегі қолданылады, ол анодта бөлінетін оттегімен келесі реакциялар бойынша әрекеттеседі:
С + 0,5О2 = СО (5.43)
және
С + О2 = СО2 (5.44)
Нәтижесінде электролиз үрдісі кезінде электролизерлерде глиноземның ыдырауы келесі химиялық реакциялар бойынша жүреді:
Al2O3 + 3C = 2Al + 3CO (5.45)
2Al2O3 + 3C = 4Al + 3CO2 (5.46)
Сонда глиноземның ыдырау кернеулігі (5.45) және (5.46) реакцияларының Гиббс энергиясының өзгеруімен анықталады. Анодта екінші реттік реакциялардың нәтижесінде СО және СО2 түзілуі жылу бөле жүреді. Бұл глиноземның ыдырау кернеулігін төмендететін анодтың деполяризациялануына себеп болады. Деполяризацияны ескермей термодинамикалық есептеулер бойынша глиноземның ыдырау кернеулігінің температураға тәуелділігі келесі теңдеумен өрнектеледі:
Uы.к. = 2,226 – 4,65·10-4(Т-1000) (5.47)
мұнда Uы.к. –глинозёмның ыдырау кернеулігі, В.
10000С температурада ыдырау кернеулігі 2,226 В болады.
Көмір анодтарымен 10000С температурада электролиздегенде деполяризацияны ескеріп, анодтағы көміртегі толығымен СО-ға дейін тотыққанда глиноземның ыдырау кернеулігі 0,948 В болады, ал анодтағы көміртегі түгел СО2-ге дейін тотыққанда – 1,048 В болады. Сонымен, есептеулер бойынша анодтық деполяризация 1,083-1,183В болады. Ал нақтылы анодтық поляризация электролиз кезінде екі есеге жуық кем болады. Бұл анодта көміртегінің тотығуы есептеулерде пайдаланғанға қарағанда күрделі жолмен жүретінін көрсетеді.
Криолитті-глиноземды балқыманың басқа құрастырушыларының 10000С температурада ыдырау кернеулігінің шамасы келесідей болады, В: NaF – 4,55, AlF3 – 3,68, CaF2 – 5,28, MgF2 – 4,63.
Электролиз кезінде ваннада кернеу 4,5-5,0 В мөлшерінше ұсталады. Осы себеппен криолитті-глиноземды балқымаларды электролиздеген жағдайда тек глинозем ғана ыдырайды, өйткені оның ыдырау кернеулігі ең төмен. Басқа компоненттер ыдырамайды.
Ионды балқымалар электрохимиясында тәжрибелік есептерді шығарған кезде «ыдыраудың жылулық кернеулігі» түсінігі жиі қолданылады, ол келесі теңдеумен анықталады:
Uн.р. = - 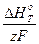 (5.48)
(5.48)
5.4.5. Катодтық және анодтық процестер
Криолитті-глинозёмды балқыманың құрылысы күрделі. Балқыманың физика-химиялық қасиеттерін зерттеу электролиз үрдісіің механизмі туралы белгілі қорытынды жасауға мүмкіндік берді.
Криолитті-глиноземді балқыманың компоненттері келесі теңдеулер бойынша ыдырайды:
Na3AlF6 = 3Na+ + AlF 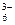 (5.49)
(5.49)
AlF 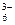 = AlF
= AlF 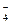 + 2F
+ 2F 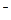 (5.50)
(5.50)
Al2O3 = 2Al3+ + 3O2- (5.51)
Бұл иондардың біразы өзара әрекеттесіп, жай иондармен тепе-теңдікте болатын тұрақтылығы біршама болатын AlO 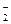 және AlO+ иондарын түзеді:
және AlO+ иондарын түзеді:
AlO 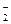 = Al3+ + 2O2- (5.52)
= Al3+ + 2O2- (5.52)
AlO+ = Al3+ + O2- (5.53)
Балқымада болатын тұздар NaF, CaF2, MgF2 диссоциацияланып, Na+, Ca2+ және Mg2+ иондарын түзеді.
Сонымен, криолитті-глиноземды балқымада электр тасымалдауға Al3+, Na+, Ca2+, Mg2+, AlF 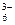 , F-, AlO
, F-, AlO 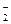 , AlO+, O2- иондары қатысады. Бірақ электродтарда ең жоғары оң (катод) және ең жоғары теріс (анод) разрядтау потенциалдары бар иондар разрядталады. Оларға Al3+ және O2- иондары жатады.
, AlO+, O2- иондары қатысады. Бірақ электродтарда ең жоғары оң (катод) және ең жоғары теріс (анод) разрядтау потенциалдары бар иондар разрядталады. Оларға Al3+ және O2- иондары жатады.
Осының салдарынан катодта жүретін электродтық реакция:
2Al3+ + 6e = 2Al (5.54)
Анодта оттегінің разрядталу процесі жүреді. Түзілетін оттегі графит анодының көміртегімен реакцияға түсіп, СО және СО2 түзеді:
2О2- - 4е +С = СО2 (5.55)
О2- - 2е + С = СО (5.56)
Сонда электролизерде келесі химиялық реакция жүреді:
Al2O3 + 2C = 2Al + CO + CO2 (5.57)
Электродтар мен электролизерде параллель реакциялар жүреді деп санауға болады.
Катодта
4Аl3+ +12e = 4Al, (5.58)
анодта
6О2- - 12е = 3О2 (5.59)
3О2 + 3С = 3СО2 (5.60)
және электролизёрде
2Al2O3 +3C = 4Al + 3CO2 (5.61)
катодта
2Аl3+ +6e = 2Al, (5.62)
анодта
3О2- - 6е = 1.5О2 (5.63)
және электролитте
Al2O3 +3C = 2Al + 3CO (5.64)
Сонымен, электролиз кезінде балқымадағы барлық компоненттерден тек қана глинозем шығындалады. Басқа компоненттердің разрядталуы электролиз үрдісінің технологиясы бұзылғанда ғана жүреді.
Электролиз үрдісі кезінде анодта бөлінетін оттегі көміртегімен әрекеттесіп анодтың күйіп шығындалуына әкеледі.1т. алюминий өндіру үшін 2т. жуық глинозем, 0,7т. анод массасы, 0,1т. криолит және басқа фторидтер, 18 МВт·сағ. электр энергиясы жұмсалады.
5.4.6 Анодтық эффект
Графитті немесе металл анодтарды қолданып ионды балқымаларды электролиздегенде анодьық эффект немесе жарқ ету деп аталатын құбылыс байқалуы мүмкін. Бұл құбылыс келесі белгілермен сипатталады:
1) Былаудағы кернеу 4,5-5,0 тен 30-40 қа, ал кейде 120 В дейін күрт көтеріледі.
2) Электролитте катод пен анодтың арасында сары немесе күлгін түсті ұсақ ұшқыннан тұратын жарық жолақ пайда болады.
3) Анодта газ көбіршіктерінің түзілуі токталады.
4) Электролизердегі электролиттің жиегі (менискі) ойықтан дөңеске айналады.
5) Анод пен балқыманың арасында жұқа газ қабыршағы пайда болып, электролит анодтан алшақтайды.
Анодтық эффект пайда болғанда ток тығыздығы сындық (критический) мәніне жетеді. Ток тығыздығы бұдан артық болғанда анодтық эффект жағдайы үнемі сақталады.
Сындық ток тығыздығының мөлшері криолитті-глиноземды балқыманың құрамына тәуелді, бірінші кезекте ондағы глиноземның құрамына:
iкр. = А  (5.65)
(5.65)
мұнда iкр.- сындық ток тығыздығы, А/см2;
Р- балқымадағы глинозем мөлшері, %;
А – тұрақты.
Электролите глиноземның концентрациясы артқанда сындық ток тығыздығы көтеріліді. 10000С температурада бұл тәуелділік 5.1-ші кестеде көрсетірген мәндермен сипатталады.
5.1- ші кесте Балқымадағы Al2O3 мөлшерінің iкр әсері..
| %Al2O3 | 1,0 | 2.0 | 3.0 | 5.0 | 7.0 | ||
| iкр,А/см2 | 0,43 | 2,02 | 3,08 | 4,44 | 7,5 | 8,9 | 10,5 |
Сындық ток тығыздығы балқығын тұздардың құрамына, температураға және электродтардың материалына тәуелді.
Балқыған хлоридтер үшін сындық ток тығыздығы фторидтердікіне қарағанда жоғары. Сілтілік металдар балқымасында бұл көрсеткіш сілтілік-жер металдар балқымасына қарағанда жоғары.
Температура көтерілгенде сындық ток тығыздығы артады.
Көмір электродтарды қолданғанда сындық ток тығыздығы метал электрод қолданғанға қарағанда аз.
Анодтық эффектің пайда болуының себебі анодтың балқымамен нашар шылануынан. Шылану нашар болғанда анодта бөлінетін газ көпіршіктері тұтас қабыршық түзе бірігіп, балқыманы анод бетінен аластатады (5.10-шы сурет).

1- электролиз қалыпты жүргенде анодта газдың бөлінуі; 2-анодтық эффектті болдыратын газ қабыршағының түзілуі.
5.10-шы сурет Анодтық эффект кезінде көмір электродта газ қабыршағының түзілуі.
Анодтың электролитпен шылануы алдымен беттік тартылуға байланысты. Беттік тартылу неғұрлым үлкен болса, шылану бұрышы соғұрлым үлкен болады, электродтың беті электролитпен соғұрлым нашар шыланады, соғұрлым сындық ток тығыздығы төмен болады. Сондықтан электролиттің беттік тартылуын азайтатын барлық факторлар электродтың бетінің жақсы шылануына себепші болады да, сындық ток тығыздығын жоғарылатады.
Анодтық эффект лазымсыз құбылыс, өйткені потенциалдың секіруі салдарынан энергия шығыны көбейеді, ток күшінің азаюы себебінен электролизердың өнімділігі төмендейді, былау аса қызып кетеді, алюминидің тоқ бойынша шығымы азаяды.
Бұл құбылыстың алдын алу үшін электролитке глиноземның жаңа үлесін қосу арқылы балқымадағы глиноземның концентрациясын көтеру қажет.
5.4.7 Ток бойынша шығымға әртүрлі факторлардың әсері.
Алюминиді электролиттік жолмен алғанда ток бойынша шығым 80-90% шегінде болады. Ток бойынша шығымға бірқатар факторлар әсер етеді.
Температураны көтергенде ток бойынша шығым алдымен артады, ал максималды шамаға жеткенде кеми бастайды. Ток бойынша шығымның максималды шамасы оптималды температурада (9500) байқалады. Температура бұл шамадан төмендегенде балқыманың тұтқырлы артады, осының салдарынан метал түйіршіктері электролитте шиеленісіп, металды ағызып алғанға дейін былаудың түбіне шөгіп үлгермейді. Температураны 9500С-дан жоғары көтеру алюминидің балқымамен әрекеттесіп AlF қосылысының түзілуіне әкеледі:
2Al + AlF3 = 3AlF (5.66)
Және де, металдық алюминидің ауадағы оттегі мен көмір қышқыл газымен әрекеттесу реакциясының жылдамдығы артады:
4Al + 3O2 = 2Al2O3 (5.67)
2Al + CO2 = Al2O3 + CO (5.68)
Бұл реакциялардың жүруі алюминидің жоғалуына әкеледі, ол ток бойынша шығымды азайтады.
Ток бойынша шығымға ток тығыздығы әсер етеді. Алюминий былауында анодтық iа, катодтық iк және орташа iор ток тығыздығын айырады, олардың арасындағы байланыс келесі теңдеумен өрнектеледі:
icр. =  (5.69)
(5.69)
Орташа ток тығыздығын көтергенде алюминидің ток бойынша шығымы артады. Ток тығыздығын көтергенде былауда кернеу де көтеріледі. Ток тығыздығы тым көп көтеріліп кетсе катодта натрий иондарының разрядталуы мүмкін, бұл ток бойынша шығымды азайтады.
Ток бойынша шығымға электродтар арасындағы қашықтық – полюсаралық қашықтық әсер етеді. Полюсаралық қашықтықты үлейту бір жағынан ток бойынша шығымды арттырады, өйткені метал түріндегі алюминидің анодқа қарай тасымалдануы қиындайды. Екінші жағынан полюсаралық қашықтықты үлкейту электролитте кедергінің өсуінен кернеудің түсуіне әкеледі, бұл қосымша энергияның шығынын арттырады. Сондықтан электролизерлерде полюсаралық қашықтықты 3-5 см мөлшерінде ұстайды.
Ток бойынша шығымға балқымадағы криолиттік қатынас әсер етеді. Криолиттік қатынас үлкейгенде ток бойынша шығым алдымен артады да, кейбір максималды шамаға жеткен соң азая бастайды. Ток бойынша максималды шығым криолиттік қатынас 2,5-2,7 шамасында болғанда байқалады. Криолиттік қатынасты бұдан төмен ұстағанда балқыманың электрөткізгіштігі азаяды, нәтижесінде электр энергиясының шығыны көбейіп, ток бойынша шығым азаяды. Криолиттік қатынасты көбейту катодта алюминимен бірге натрий иондарының разрядталуына әкелуі мүмкін. Бұл да ток бойынша шығымды азайтады.
5.4.8 Электролизердің құрылысы және жұмысы
Алюминиді электролиттік жолмен алуда екі түрлі ванналар қолданылады: престеліп күйдірілген анодтар және үздіксіз өздігінен күйдірілетін анодтар қолданатын. Қазіргі кезде алюминиді алу негізінен үздіксіз өздігінен күйдірілетін анодтар қолданатын ванналарда жүргізіледі. Токты жоғарыдан беретін және өздігінен күйдірілетін аноды бар ваннаның құрылысы 5.12-ші сурете келтірілген.

1-болат қазықтар; 2-анодты пісіру конусы; 3-темір жапқыштар;4-газдарды сору
5.12-ші сурет Токты жоғарыдан келтіретін ваннаның құрылысы
Электролизерлер тік бұрышты көмір блоктар және плиталардан жасалады. Катод қызметін көмір блоктардан құрастырылған еден атқарады. Анод ретінде анодтық массадан жасалған көмір электродтар қолданылады. Анодтық масса ерекше технология бойынша жасалады. Электролизердің қабырғалары көмір плиталардан салынады. Қабырғаларының сырты кірпішпен қаланып, сыртқы болат қаптамамен арасы қышқақ ұнтағымен толтырылады. Катодты блоктарда арықшалар жасалады, оларға болат өзекшелер (стержень) салып, шойынмен құйып бекітеді. Бұл өзекшелерге электр тоғын жеткізуші шиналар бекітіледі.
Ваннаның үстіңгі жағында алюминий беттерінен жасалған қаптаманың ішінде анод ілінген. Қаптаманың (кожух) ішіне анодтық масса тиеледі. Электрод төмен түскен сайын анодтық масса қызады, балқиды, қоюланады және қатады. Электролитке батырылған массаның төменгі қабаттары пісіріледі де, «пісірудің қатты конусын» түзеді. Анод күйген сайын арнайы механизм арқылы оны біртіндеп түсіріп отырады. Алюминий қаптама электролитте балқиды. Қаптамаға үстінен әлсін-әлсін жаңа анодтық масса тиеп отырады. Алюминий қаптаманы қозғалмайтын болаттан жасалғанмен ауыстыруға болады, оның ішінде күйдірілген масса қабырғаларының бойымен төмен жылжып отырады. Анодқа ток ішіне қағылған болат қазықшалар арқылы беріледі.
Зиянды анод газдарын сорып алу үшін ваннада сырғып ашылатын немесе көтеріліп ашылатын темір жапқыштар болады.
Электролиз кезінде бөлінген алюминидің тығыздығы электролиттікіне қарағанда жоғары, сондықтан электролизердің еденінде жиналады. Былаудан сұйық алюминий 2-3 тәулікте бір рет вакуумдық шөміш арқылы сорылып алынады.
5.4.9 Алюминиді рафинирлеу және құю.
Былаудан алынған алюминиде оның сапасын нашарлататын бірқатар қоспалар болады. Электролиттік алюминидегі қоспаларды үш топқа бөлуге болады: метал емес (элeктролит, глинозём, алюминий карбиді, көмір түйіршіктері); металдық (Fe,Ti, Si, Na және Ca); газ тәрізді- негізінен сутегі. Сондықтан алюминий рафинирлендіріледі.
Метал емес және газ тәрізді қоспалардан, натрий және кальциден алюминиді хлрмен үрлеу арқылы немесе қайта балқыту арқылы рафинирлейді.
Хлорлауды іші отқа төзімді кірпішпен қаланған ерекше шөміште жүргізеді. Шөмішке сұйық алюминий құяды, қалпақтың астына қояды, ішіне графит құбыр енгізеді де балқыған металға хлор газын үрлейді. Шөміште температура 7500С мөлшерінде ұсталады. Хлормен байланыс күшінің азаюы бойынша металдарды келесі қатарға тізуге болады: Ca, Na, Mg, Al, Mn, Zn, Si, Fe, Ni. Cu. Сондықтан алюминидің қатысуымен тек Ca және Na ғана хлорланады. Бұл металдардың хлоридтері балқыманың үстіне қалқып шығады. Басқа металдар балқымада қалады. Хлормен үрлеген кезде алюминидің біраз бөлігі ғана хлорланады:
2Al + 3Cl2 = 2AlCl3 (5.70)
Алюминий хлоридінің қайнау температурасы 1800С, сондықтан ол газ түрінде түзіледі. Металдан шығатын газ көпіршіктері өздерімен бірге метал емес қоспаларды және еріген газдарды ілестіріп алып шығады. Бұл әдіспен тазартылған металдың бірнеше шығарымы электр пешіне құйылады, онда балқыма түндырылады және әртүрлі шығарымдардың құрамдары біркелкілендіріледі. Пеште балқыма 670-7300С дейін қыздырылады. 7-10 тәулік бойы тұндырылған метал құйылады, ал ванна қождан және оксидтерден мұқият тазартылады.Пеште металдың күюі 1,5-2,0%.
Тазартылған метал конвейерлі құю машиналарында ұзындығы 9-10м құймаға құйылады да, тұтынушыларға жіберіледі. Металды тағы да вейербарс деп аталатын ерекше пішінді құймаметалға құяды, олардан сым жасайды.
Рафинирленген алюминиде 99,0- 99,85 % Al болады.
Дата публикования: 2015-07-22; Прочитано: 1391 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
