 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические методы
|
|
К физико-химическим методам качественного анализа относятся спектральный, масс-спектрометрический, хроматографический и другие виды анализы.
Основой качественного спектрального анализа является свойство каждого химического элемента излучать характерный линейчатый спектр. Задача качественного спектрального анализа сводится к отысканию линий определяемого элемента в спектре пробы. Принадлежность линии данному элементу устанавливается по длине волны и интенсивности линии.
Общее число линий в спектре многих элементов очень велико: например, спектр тория насчитывает свыше 2500 линий, а спектр урана – более 5000. Нет необходимости определять длины волн всех спектральных линий в спектре пробы. Для целей качественного анализа необходимо установить наличие или отсутствие в спектре так называемых аналитических или последних линий.
При уменьшении содержания элемента в пробе интенсивность линий этого элемента в спектре будет уменьшаться, некоторые линии исчезнут и число линий уменьшится. При какой-то очень малой концентрации останется всего несколько линий. Это и есть последние линии, по которым обычно проводится качественный анализ. Последние линии хорошо изучены, их длины волн и характеристику интенсивности можно найти в специальных таблицах и атласах спектральных линий. Это обычно, но не всегда, резонансные линии. В таблицах их часто отмечают индексами U1, U2 и т. д. или V1, V2 и т. д. Индекс U1 показывает, что при возбуждении спектра в дуге эта линия исчезает последней, линия с индексом U2 исчезает предпоследней и т. д. Индексы V1, V2 и т. д. относятся к этой же последовательности исчезновения линий в искровом спектре. Однако эта последовательность не абсолютна. В зависимости от условий возбуждения и состава пробы она может несколько изменяться.
Для расшифровки спектра и определения длины волны анализируемой линии пользуются спектрами сравнения,в которых длины волн отдельных линий хорошо известны. Чаще всего для этой цели используют спектр железа, имеющий характерные группы линий в разных областях длин волн.
Спектр анализируемого вещества обычно фотографируют над спектром железа. На рис. 1 представлено схематическое изображение небольшого участка спектра железа и спектра исследуемой пробы.
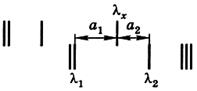
Рис. 1. Определение длины волны спектральной линии
Для определения длины волны заданной линии λ x измеряют расстояние а 1 от этой линии до ближайшей к ней линии спектра железа, длина волны которой λ1 точно известна, и расстояние а 2 от линии λ x до другой линии с известной длиной волны λ2. А затем по формуле находят длину волны неизвестной линии:

Расстояние между линиями можно измерить с помощью измерительного микроскопа МИР-12, спектропроектора ПС-18 или компаратора.
При проведении качественного спектрального анализа часто пользуются атласом спектральных линий. На планшетах этого атласа нанесены линии спектра железа и аналитические линии различных элементов. Совместив изображение спектра железа, полученное с помощью спектропроектора ПС-18, с линиями планшета, отмечают, с какой аналитической линией на планшете совпадает линия анализируемого спектра.
Основной причиной ошибок является так называемое наложение спектральных линий, связанное с недостаточной дисперсией рядовых спектральных приборов.
Спектральным анализом качественно можно определить более 80 элементов. Предел обнаружения методами качественного спектрального анализа колеблется для разных элементов в очень широких пределах: от 10-2 (Hg, Os, U и др.) до 10-5% (Na, В, Bi и др.). Следует отметить, что отсутствие линии какого-либо элемента в спектре означает лишь, что его концентрация в пробе меньше предела обнаружения.
Качественный масс-спектрометрический анализ основан на измерении массы ионов. Идентификация масс проводится по положению линии на фотопластинке, которое фиксируют, измеряя расстояние между линиями с известной массой и анализируемой линией.
Масс-спектры многих веществ изучены достаточно подробно и составлены специальные атласы. При использовании таких атласов учитывается, например, что двухзарядный ион с массой 56 дает такую же линию в спектре, как и однозарядный ион с массой 28, а также условия получения спектра – температуру ионного источника, энергию электронов и т.д.
Качественный состав вещества может быть установлен с помощью хроматографической методики по характеристикам полученной хроматограммы или по результатам анализа компонентов смеси после прохождения хроматографической колонки подходящим химическим или физико-химическим методом.
Типичная хроматограмма приведена на рис. 2.

Рис. 2. Хроматограммы смеси воды и кислот (115 °С):
1 — вода; 2 — муравьиная кислота; 3 — уксусная кислота; 4 — пропионовая кислота;
5 — изомасляная кислота; 6 — н -масляная кислота; 7 — изовалериановая кислота
Каждому компоненту смеси отвечает свой пик и последовательность появления пиков на хроматограмме закономерна: она соответствует последовательности кислот в гомологическом ряду. Собственно хроматографический качественный анализ основан на использовании характеристик удерживания – времени удерживания или пропорционального ему удерживаемого объема и индексов удерживания. Для этой цели применяются относительные удерживаемые объемы, которые в значительно меньшей степени, чем абсолютные величины, подвержены действию случайных факторов.
Идентификация исследуемых веществ проводится сравнением полученных и табличных данных. Условия опыта не должны отличаться от тех, в которых были получены табличные данные.
Идентификация вещества по его хроматограмме может быть выполнена также методом тестеров, когда сравнивают объем или время удерживания компонента анализируемой смеси и эталона, найденные в одних и тех же условиях опыта. Иногда эталонное вещество, наличие которого предполагается в анализируемой смеси, специально вводят в пробу и сравнивают высоту и площадь пиков на хроматограммах, полученных до и после введения эталона. Увеличение высоты или площади пика рассматривается как указание на присутствие предполагаемого компонента в пробе. Однако этот метод не вполне надежен, так как удерживаемые объемы довольно многих веществ близки между собой. Трудности идентификации преодолеваются, например, хроматографированием пробы на колонках с разными сорбентами. Получение одинаковых результатов при использовании разных сорбентов увеличивает надежность анализа.
В настоящее время разработаны и успешно применяются также различным многоступенчатые схемы. В таких схемах после разделения смеси на первой колонке полученные фракции подаются на колонки второй ступени, где достигается более тонкое разделение и более точная идентификация вещества, так как имеют дело с болен простыми смесями, чем на первой колонке.
В газожидкостной хроматографии для качественного анализа часто используют индексы удерживания Ковача I:
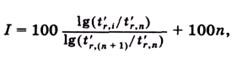
где t'r — приведенное время удерживания; п — число атомов углерода в алкане; i — определяемое вещество.
Стандартом при определении индекса удерживания являются два соседних нормальных алкана, один из которых элюируется до, а второй после исследуемого соединения, т. е. t'r;n < t'r,i < tr,(n+1). При программировании температуры индекс удерживания рассчитывается по температуре удерживания Тr:

Идентификация вещества по индексу удерживания производится путем хроматографирования соединения с последующим хроматографированием в тех же условиях двух соседних алканов, выбранных в качестве стандарта. Результаты анализа по индексу удерживания оказываются более надежными, чем по удерживаемому объему, так как индекс удерживания является более индивидуальной характеристикой вещества. Индексы удерживания многих веществ при определенных температурах имеются в соответствующих справочных таблицах, что облегчает проведение качественного анализа.
Накопленный экспериментальный материал позволил обнаружить некоторые закономерности и установить определенные зависимости между хроматографическими характеристиками и физико-химическими свойствами вещества.
Например, что индексы удерживания и удерживаемые объемы связаны простой зависимостью с числом атомов углерода у членов гомологического ряда, с температурами кипения гомологов и другими характеристиками и свойствами вещества. Эти зависимости существенно расширяют возможности хроматографии. Соответствующие графики, например, зависимости удерживаемого объема от температуры кипения почти линейны и их широко используют для идентификации компонентов смеси. Если принадлежность компонента к гомологическому ряду известна, то найденная по такому графику температура кипения или другое свойство достаточны для идентификации компонента. Установлено, что индексы удерживания соседних членов в любом гомологическом ряду различаются примерно на 100.
Эффективным оказалось применение независимой аналитической идентификации продуктов хроматографического разделения и сочетание газовой хроматографии с другими методами исследования: ИК-спектроскопией и масс-спектрометрией, а также использование селективных и последовательно работающих детекторов. Методом масс-спектрометрии можно проводить непрерывный качественный анализ компонентов смеси и для анализа бывает достаточно самых небольших количеств вещества. Такой комбинированный метод получил название хроматомасс-спектрометрии. Возможно использование также методов ядерного магнитного резонанса, пламенной фотометрии, абсорбционной спектроскопии и других, включая химические методы.
Дата публикования: 2015-07-22; Прочитано: 929 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
