 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Сероводородная классификация катионов
|
|
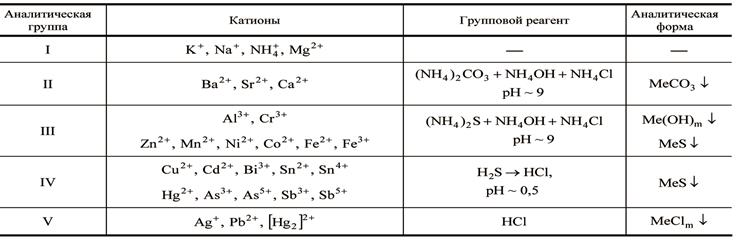
Ø Кислотно-щелочная классификация была предложена в 60-х гг XX в проф. Бесковым. В основе классификации лежит отношение катионов к растворам HCl, H2SO4, щелочей и NH3. Выделяют 6 аналитических групп:
· I группа: K+, Na+, NH4+. Группового реактива нет, т.к. все соли хорошо растворимы в воде.
· II группа: Pb2+, Hg22+, Ag+. Групповой реактив HCl.
· III группа: Ca2+, Ba2+, Sr2+. Групповой реактив Н2SO4.
· IV группа: Al3+, Cr3+,Zn2+, Sn2+, Sn4+, As3+, As5+. Групповой реактив NaOH(избыток).
· V группа: Mn2+, Mg2+, Fe2+, Fe3+, Bi3+,Sb3+, Sb5+. Групповой реактив NH4OH.
· VI группа: Cu2+, Hg2+, Cd2+, Co2+, Ni2+. Групповой реактив NH4OH(избыток).
Преимущества кислотно-щелочной классификации:
1. В этой системе использованы основные свойства элементов, отношение их к кислотам и щелочам, амфотерность гидроксидов и способность элементов к комплексообразованию.
2. Затраты времени на проведение работ сокращаются на 40%.
3. Исключается использование газообразного H2S в анализе.
Недостатки кислотно-щелочной классификации:
Система недостаточно разработана. Не все катионы классифицированы.
Для анионов существуют 2 классификации: по групповому реактиву и по окислительно-восстановительным свойствам.
Ø По групповому реактиву все анионы можно поделить на 3 группы:
· I группа: CO32−, С2О42−, SO42−, SO32−, S2O32−, SiO32−, CrO42−, PO43−, В4О7−. Групповой реактив BaCl2. Соли не растворимы в воде, но растворимы в минеральных кислотах.
· II группа: Cl−, Br−, I−, S2−. Групповой реактив AgNO3 в присутствии HNO3.
· III группа: NO3−, NO2−, CH3COO−. Нет группового реактива. Все соли растворимы в воде.
Ø По окислительно-восстановительным свойствам анионы делятся на 3 группы:
· I группа – восстановители:Cl−, Br−, I−, S2−, SO32−, S2O32−, С2О42−. Групповой реактив KMnO4 (0,01 н.), подкисленный H2SO4. Эти ионы восстанавливают в кислой среде MnO4− и обесцвечивают раствор.
· II группа – окислители: NO3−, NO2−, CrO42−. Групповой реактив KI(рр), подкисленный H2SO4, а также раствор дифениламина в H2SO4.
· III группа – индифферентные ионы: CO32−,, SO42−, SiO32−, PO43−, CH3COO−. Нет группового реактива. Не проявляют окислительно-восстановительных свойств по отношению к MnO4−, KI и дифениламину.
Дата публикования: 2015-07-22; Прочитано: 2450 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
