 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы качественного анализа
|
|
Лекция 3
Качественный анализ
Список рекомендуемых источников:
1. Васильев В.П. Аналитическая химия: В 2 кн.: Кн. 1: Титриметрические и гравиметрические методы анализа: учеб. для студ. вузов, обучающихся по химико-технол. спец. – 4-е изд., стереотип. – М.: Дрофа, 2004. – 368 с. (С. 33 – 35, 263, 309 – 311).
2. Лебедева М.И. Аналитическая химия и физико-химические методы анализа: учеб. пособие / М.И. Лебедева. – Тамбов: Изд-во Тамб. гос. техн. ун-та, 2005. – 216 с. – http://window.edu.ru/window_catalog/files/r38085/tstu2005-134.pdf
Качественный анализ – это анализ, целью которого является установление содержащихся в пробе химических элементов, ионов, веществ.
Методы качественного анализа
Методы качественного анализа различны: химические, физические, физико-химические.
Методы качественного анализа, позволяющие определить в анализируемом веществе содержание отдельных элементов, называют элементным анализом;функциональных групп – функциональным анализом; индивидуальных химических соединений, характеризующихся определенной молекулярной массой, – молекулярным анализом.
Совокупность разнообразных химических, физических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
Химические методы основаны на том, что открываемый элемент или ион переводят в какое-либо соединение, обладающее определенными свойствами. Происходящее при этом химическое превращение называется аналитической реакцией. Вещество, которое вызывает это превращение, называется реактивом (реагентом).
Аналитические реакции можно классифицировать следующим образом:
1. Групповые реакции: один и тот же реактив реагирует с группой ионов, давая одинаковый сигнал. Например, для отделения группы ионов (Ag+, Pb2+, Hg22+) используют реакцию их с Cl−-ионами, при этом образуются белые осадки (AgCl, PbCl2, Hg2Cl2).
2. Избирательные (селективные) реакции.
Например: йодокрахмальная реакция. Впервые ее описал в 1815 г немецкий химик Ф. Штромейер. Для этих целей используют органические реагенты.
Например: диметилглиоксим + Ni2+ → образование ало-красного осадка диметилглиоксимата никеля.
Изменяя условия протекания аналитической реакции, можно неизбирательные реакции сделать избирательными.
Например: если реакции Ag+, Pb2+, Hg22+ + Cl− проводить при нагревании, то PbCl2 не осаждается, так как он хорошо растворим в горячей воде.
3. Реакции комплексообразования используются для целей маскирования мешающих ионов.
Например: для обнаружения Со2+ в присутствии Fe3+-ионов с помощью KSCN, реакцию проводят в присутствии F−-ионов. При этом Fe3+ + 4F− → [FeF4]−, Kн = 10−16, поэтому Fe3+-ионы закомплексованы и не мешают определению Co2+-ионов.
В аналитической химии используются следующие реакции:
1. Гидролиз (по катиону, по аниону, по катиону и аниону):
Al3+ + HOH ↔ Al(OH)2+ + H+;
CO32− + HOH ↔ HCO3− + OH−;
Fe3+ + (NH4)2S + HOH → Fe(OH)3 +...
2. Реакции окисления-восстановления:
2MnSO4 + 5K2S2O8 + 8H2O 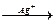 2HMnO4 + 10KHSO4 + 2H2SO4
2HMnO4 + 10KHSO4 + 2H2SO4
3. Реакции комплексообразования:
СuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
4. Реакции осаждения:
Ba2+ + SO42− → BaSO4↓
В качественном анализе используются только те реакции, которые сопровождаются какими-либо хорошо заметными внешними эффектами:
1. Образование или растворение осадка:
Hg2+ + 2I− → HgI2↓;
красный
HgI2 + 2KI− → K2HgI4
бесцветный
2. Появление, изменение, исчезновение окраски раствора (цветные реакции):
Mn2+ → MnO4− → MnO42−
бесцветный фиолетовый зеленый
3. Выделение газа:
SO32− + 2H+ → SO2↑ + H2O.
4. Реакции образования кристаллов строго определенной формы (микрокристаллоскопические реакции).
5. Реакции окрашивания пламени.
Аналитические реакции можно проводить «сухим» и «мокрым» путем.
Примеры реакций, проводимых «сухим» путем:
– реакции окрашивания пламени (Na+ – желтый; Sr2+ – красный; Ba2+ – зеленый; Са2+ – кирпично-красный, K+ – фиолетовый; Li+ – малиновый, Tl3+ – зеленый, In+ – синий и др.);
– при сплавлении Na2B4O7 и Co2+, Na2B4O7 и Ni2+, Na2B4O7 и Cr3+ образуются «перлы» буры различной окраски. Например, соединения Co2+ дадут интенсивно-синюю окраску, Cr3+ – изумрудно-зеленую.
Окраска перла зависит от того, в каком конусе (зоне) пламени происходи нагревание – окислительном или восстановительном. В центре пламени у основания фитиля температура достигает 3200С – это зона восстановления, выше находится зона окисления, температура в верхней части доходит до 15500С.
Методика получения перлов проста. Берут платиновую проволоку, один конец сгибают в ушко, а другой впаивают в стеклянную трубочку. Платиновое ушко нагревают в пламени горелки и горячее погружают в соль. Приставшую соль сначала держат под пламенем горелки, чтобы не слишком интенсивно выделялась вода, а затем сплавляют в бесцветный перл (соль буры Na2B4O7 · 7Н2О). После этого еще горячим перлом прикасаются к исследуемому веществу и затем вновь вносят в окислительную часть пламени, получая цветной перл. Наблюдают полученный цвет в холодном и горячем состоянии.
Чаще всего аналитические реакции проводят в растворах («мокрый» путь). Анализируемый объект (индивидуальное вещество или смесь веществ) может находиться в любом агрегатном состоянии (твердом, жидком, газообразном). Объект для анализа называется образцом, или пробой. Один и тот же элемент в образце может находиться в различных химических формах. Например: S0, S2−, SO42−, SO32− и т.д. В зависимости от цели и задачи анализа после переведения в раствор пробы проводят элементный анализ (определение общего содержания серы) или фазовый анализ (определение содержания серы в каждой фазе или в ее отдельных химических формах).
В зависимости от того, с какими количествами вещества проводят операции при выполнении аналитической реакции, различают:
– макроанализ – 1 – 10 г, 10 – 100 мл;
– полумикроанализ – 0,05 – 0,5 г, до 10 мл;
– микроанализ – 0,001 – 10-6 г, 0,1 – 10-4 мл;
– ультрамикроанализ – 10-6 – 10-9 г, 10-4 – 10-6 мл;
– субмикроанализ – 10-9 – 10-12 г, 10-7 – 10-10 мл.
Существует капельный метод анализа, введенный в аналитическую практику Н.А. Тананаевым (1920). Реакции проводят на фарфоровой пластинке, предметном стекле, но чаще всего на полоске фильтровальном бумаги.
Выполняя ту или иную аналитическую реакцию необходимо строго соблюдать определенные условия ее протекания (температура, рН раствора, концентрация) с тем, чтобы она протекала быстро и имела достаточно низкий предел обнаружения. Например, осадки, растворимость которых повышается с увеличением температуры, необходимо получать только на холоду. В тоже время некоторые осадки получают только при нагревании.
Очень важное условие – достаточно большая концентрация открываемого иона в растворе. Наименьшее количество вещества (иона), которое можно открыть с помощью данного реагента в капле исследуемого раствора объемом в 1 микролитр (10-6 л) называется чувствительностью реакции.
Количественно чувствительность характеризуется следующими показателями:
– открываемый минимум (m) – это наименьшее количество вещества или иона, которое может быть открыто посредством данной реакции при определенных условиях.
m = спред.·Vmin· 106 мкг
m = Vmin· 106 / Vпред мкг
где спред – предельная концентрация; Vmin – минимальный объем предельно разбавленного раствора; Vпред – предельное разбавление.
– Предельная концентрация (спред) – это отношение единицы массы определенного иона к массе наибольшего количества растворителя.
 , [ мкг/мл ]
, [ мкг/мл ]
– Предельное разбавление (Vпред) – это величина, обратная предельной концентрации и показывающая, в каком количестве водного раствора (в мл) содержится 1 г определяемого иона.
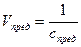 ;
; 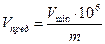
– Минимальный объем (Vmin) – это объем раствора, содержащий открываемый минимум определенного иона.
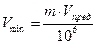 , [ мл ]
, [ мл ]
Чувствительность реакции, служащая для открытия одного и того же иона, может очень сильно различаться. Например, чувствительность реакции на Cu2+:
– если используется HCl, то m = 1 мкг, образуется комплекс [CuCl4]2- желто-зеленого цвета;
– если используется NH3, то m = 0,2 мкг, образуется комплекс [Cu(NH3)4]2+ синего цвета;
– если используется K4[Fe(CN)3], то m = 0,02 мкг, образуется комплекс Cu2[Fe(CN)6] красно-бурого цвета.
Для повышения чувствительности реакции можно использовать следующие приемы:
– увеличить продолжительность реакции, что особенно эффективно, если в ней принимают участие неэлектролиты или слабые электролиты.
– добавить к раствору этиловый спирт, понижающий растворимость неорганических соединений, если в реакции наблюдается образование осадка;
– взболтать водную реакционную смесь с какой-либо несмешивающейся с водой органической жидкостью.
В исследуемом растворе может присутствовать не один ион, а несколько. Применяя специфические реакции, можно открывать соответствующий ион дробным методом, т.е. непосредственно в отдельных порциях исследуемого раствора, не обращая внимания на те ионы, которые соединяются с данным. Дробный анализ был открыт Тананаевым в 1950 г.
Достоинством дробного анализа является быстрота его выполнения. Большую роль он играет тогда, когда анализу подвергается смесь с ограниченным количеством ионов и состав смеси приблизительно известен.
Недостатком дробного метода является в некоторых случаях отсутствие надежных специфических реакций для определенных ионов.
Поэтому для таких ионов необходимо разработать определенную последовательность проведения реакций открытия отдельных ионов, представляющую собой систематический ход анализа. Он состоит в том, что к открытию каждого иона приступают лишь тогда, когда все другие ионы, мешающие его открытию, будут предварительно открыты и удалены. Например, анализ смеси, содержащей Ba2+ и Са2+, открывают оксалат-ионом С2О42-:
Ва2+ + С2О42- → ВаС2О4↓ (желтый)
фильтрат-Са2+ + С2О42- → СаС2О4↓ (белый)
При систематическом ходе анализа ионы выделяются из сложных смесей не по одному, а целыми группами с помощью специальных реактивов, дающих одинаковую реакцию. Эти реактивы называются групповыми реагентами (групповыми реактивами). Такие реактивы значительно упрощают проведение анализа.
Дата публикования: 2015-07-22; Прочитано: 3819 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
