 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Наряду с практически необратимыми химическими реакциями:
|
|
Наряду с практически необратимыми химическими реакциями:
Cu(OH)2  CuO + H2O;
CuO + H2O;
СaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl↓ и др.
известны многочисленные процессы, когда химическое превращение не доходит до конца, а возникает равновесная смесь всех участников и продуктов реакции, находящихся как в левой, так и в правой частях стехиометрического уравнения реакции. Так, при стандартных условиях обратимой является система:
2NO2(г) 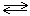 N2O4(г).
N2O4(г).
Рассмотрим особенности протекания обратимых процессов на примере системы, которая, в общем виде, имеет вид:
mA + nB 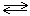 pC + qD.
pC + qD.
При условии, что прямая → и обратная ← реакции протекают в одну стадию, согласно закону действующих масс значения скоростей для прямой (V прям) и обратной (V обр) реакций описываются следующими кинетическими уравнениями:
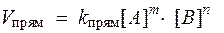
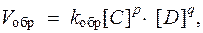
где k прями k обр - константы скорости, соответственно, прямой и обратной реакций.
В начальный момент времени (см. рис. 6.2) концентрации исходных веществ [A] и [B], а следовательно, и скорость прямой реакции имеют максимальное значение. Концентрации продуктов реакции [С] и [D] и скорость обратной реакции в начальный момент равны нулю. В ходе реакции концентрации исходных веществ уменьшаются, что приводит к снижению скорости прямой реакции. Концентрации же продуктов реакции, а следовательно, и скорость обратной реакции возрастают. Наконец, наступает момент, при котором скорости прямой и обратной реакций становятся равными.
Состояние системы, при котором Vпрям = Vобр называется химическим равновесием. Это равновесие является динамическим, поскольку в системе имеет место двусторонняя реакция - в прямом (A и B - реагенты, C и D - продукты) и в обратном (A и B - продукты, C и D - реагенты) направлениях.
В обратимой системе, находящейся в состоянии равновесия, концентрации всех участников процесса называются равновесными концентрациями, так как при этом постоянно и с одинаковой скоростью протекают как прямая, так и обратная реакции.
V реакц.

V прям.

V обр.
Т
Дата публикования: 2015-07-22; Прочитано: 267 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
