 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Скорость химических реакций
|
|
1. В зависимости от физического состояния реагирующих веществ химические реакции подразделяют на:
А) экзотермические и эндотермические,
Б) обратимые и необратимые,
В) каталитические и некаталитические,
Г) гомогенные и гетерогенные.
2. Гомогенными являются реакции:
1) CО + O2 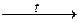
2) Zn + 2HCl ®
3) H2O + SO3(ж) ®
4) H2 + Cl2 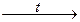
3. Скорость гомогенной реакции можно вычислить выражениями:
1. 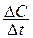 , 2.
, 2. 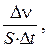 3.
3. 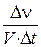 , 4.
, 4. 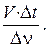
4. Единица скорости гомогенной реакции:
А) моль/л·с,
Б) моль/с,
В) моль/л·с,
Г) л/моль·с.
5. В ходе гомогенной реакции
А + 2 B ® 2 C + D:
1) концентрации А и В убывают,
2) концентрация С возрастает быстрее, чем концентрация D,
3) концентрация В убывает быстрее, чем концентрация А,
4. скорость реакции остается постоянной.
6. Изменение во времени концентрации образующегося в реакции вещества верно отражает линия:
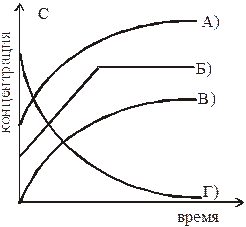
7. Изменение во времени концентрации исходного вещества в реакции, протекающей до конца, верно описывает кривая:

8. На графике приведено изменение во времени объема CO2, образующегося при разложении CaCO3. В каком интервале времени (А–Г) скорость разложения CaCO3 наименьшая?
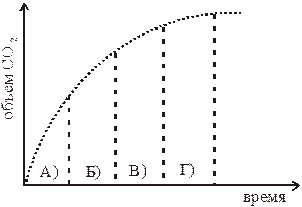
9. Скорость какой реакции не зависит от того, по какому веществу ее вычисляют?
А) H2 + S(пары) 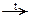 H2S,
H2S,
Б) 3H2 + N2  2NH3,
2NH3,
В) 2H2 + O2 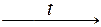 2H2O,
2H2O,
Г) 2SO2 + O2  2SO3.
2SO3.
10. Скорость реакции
3H2 + N2  2NH3
2NH3
будет иметь большее значение, если ее вычислять по изменению концентрации:
А) аммиака,
Б) водорода,
В) азота,
Г) азота и водорода.
11. На скорость реакции влияют:
1) природа реагирующих веществ,
2) концентрация реагирующих веществ,
3) температура реакционной системы,
4) присутствие катализатора в реакционной системе.
12. Основной закон химической кинетики устанавливает зависимость скорости реакции от:
А) температуры реагирующих веществ,
Б) концентрации реагирующих веществ,
В) природы реагирующих веществ,
Г) времени протекания реакции.
13. Химическая кинетика:
1) раздел физики,
2) изучает скорость химической реакции,
3) использует закон действующих масс,
4) изучает зависимость скорости реакций от условий их протекания.
14. Я.Х. Вант-Гофф:
1) первый лауреат Нобелевской премии по химии,
2) изучал зависимость скорости реакции от температуры,
3) изучал зависимость скорости реакции от концентрации ве-ществ,
4. сформулировал закон действующих масс.
15. В одинаковых условиях быстрее протекает реакция:
А) Ca + H2O ®
Б) K + H2O ®
В) Mg + H2O ®
Г) Zn + H2O ®
16. Скорость выделения водорода наибольшая в реакции:
А) Zn + HCl (5-процентный р–р) ®
Б) Zn + НСl (10-процентный р–р) ®
В) Zn + HCl (15-процентный р–р) ®
Г) Zn + HCl (30-процентный р–р) ®
17. Явление воспламенения тлеющей лучинки в сосуде с кислородом отражает зависимость скорости реакции от:
А) общего давления в системе,
Б) природы реагирующих веществ,
В) концентрации кислорода,
Г) объема реакционной системы.
18. Концентрация реагирующего вещества влияет на скорость реакции, если это вещество в реакцию взято в:
1) твердом состоянии,
2) газообразном состоянии,
3) растворенном состоянии.
19. Вычислите среднюю скорость реакции A + B = C (моль/л×с), если известно, что исходная концентрация А составляла 0,8 моль/л, а через 10 секунд стала 0,6 моль/л.
А) 0,2, Б) 0,01, В) 0,1, Г) 0,02.
20. Зависимость между концентрацией и давлением газообразного вещества описывает равенство:
А) C = PRT, Б) p = CRT,
В) p =  Г) C =
Г) C = 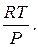
21. На сколько моль/л уменьшились концентрации веществ A и B в реакции A + 2 B ® 3 C, если известно, что за это же время концентрация С увеличилась на 4,5 моль/л?
D С А D С B
А) 1; 2,
Б) 1,5; 3,
В) 3; 1,5,
Г) 2; 1.
22. Вычислите среднюю скорость реакции 2CO + O2 ® 2CO2 (моль/л×с), если известно, что исходная концентрация CO составляла 0,60 моль/л, а через 10 секунд стала 0,15 моль/л. На сколько моль/л изменилась за этот промежуток времени концентрация CO2?
А) 0,045; 0,45,
Б) 0,045; 0,90,
В) 0,045; 0,045,
Г) 0,45; 0,45.
23. На сколько градусов нужно нагреть систему, чтобы скорость протекающей в ней реакции увеличилась в 2–4 раза?
А) 150, Б) 10, В) 200, Г) 50.
24. Скорость реакции при 20°С равна 0,2 моль/л×с. Определите скорость реакции при 60 °C (моль/л×с), если температурный коэффициент скорости реакции равен 3.
А) 16,2, Б) 32,4, В) 8,1, Г) 4,05.
25. Эмпирическую зависимость скорости реакции от температуры верно отражает уравнение:
А) 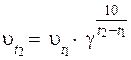 ,
,
Б) 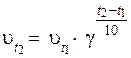 ,
,
В) 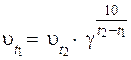 ,
,
Г) 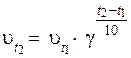 .
.
26. Скорость реакции при 20°С равна 0,08 моль/л×с. Вычислите скорость реакции при 0 °С (моль/л×с), если температурный коэффициент скорости реакции равен 2.
А) 0,16, Б) 0,04, В) 0,02, Г) 0,002.
27. Во сколько раз возрастет скорость реакции при повышении температуры на 40°С, если температурный коэффициент скорости реакции равен 3?
А) 64, Б) 243, В) 81, Г) 27.
28. На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 64 раза, если температурный коэффициент скорости реакции равен 4?
А) 60, Б) 81, В) 27, Г) 30.
29. Вычислите температурный коэффициент скорости реакции, если известно, что при повышении температуры на 50°С скорость реакции возрастает в 32 раза.
А) 3, Б) 2, В) 4, Г) 2,5.
30. Причиной роста скорости реакции с ростом температуры является увеличение:
А) скорости движения молекул,
Б) числа столкновений между молекулами,
В) доли активных молекул,
Г) стабильности молекул продуктов реакции.
31. MnO2 ускоряет реакции:
1) 2KClO3 ® 2KCl + 3O2,
2) 2Al + 3I2 ® 2AlI3,
3) 2H2O2 ® 2H2O + O2,
4) 2SO2 + O2 ® 2SO3.
32. По каталитическим реакциям в промышленности получают:
1) соляную кислоту,
2) серную кислоту,
3) аммиак,
4) азотную кислоту.
33. Катализатор:
1) участвует в реакции,
2) используется только в твердом состоянии,
3) не расходуется в ходе реакции,
4) в своем составе обязательно содержит атом металла.
34. Из приведенных веществ в качестве катализатора используются:
1. H2O,
2. V2O5,
3. MnO2 ,
4. Pt.
35. Вещества, уменьшающие активность катализатора, называются:
А) промоторами,
Б) регенераторами,
В) ингибиторами,
Г) каталитическими ядами.
36. Каталитической не является реакция:
A) (C6H10O5) n + n H2O ® n C6H12O6,
Дата публикования: 2015-07-22; Прочитано: 730 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
