 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Процесс сжатия. a) Средний показатель адиабаты сжатия k1
|
|
a) Средний показатель адиабаты сжатия k1
определяется по номограмме, приведенной на рис. 2.3, по следующей методике. Например, для степени сжатия e=8,5 и температуры Та=338 °С на оси абсцисс номограммы, на отрезке, соответствующем e=8,5, проводится вертикальная проекция (показано на рис. 2.3) до пересечения с кривой температуры Та =340 °С и далее вверх до точки, расположенной между кривыми температур Та =340 °С и Та =330 °С на расстоянии, соответствующей Та =338 °С. Для нахождения этого расстояния пользуются методом интерполирования. Для этого измеряют линейкой расстояние между кривыми температур Та =340 °С и Та =330 °С на линии, соответствующей степени сжатия 8,5. Например, это расстояние равно 6 мм, что эквивалентно интервалу температур 10 °С. Далее, составляется пропорция 10 °С - 6 мм, а 2 °С – х мм. Отсюда, 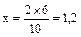 мм.После этого, откладываем на номограмме от кривой Та =340 °С вверх, в сторону уменьшения температуры, величину отрезка = 1,2 мм.
мм.После этого, откладываем на номограмме от кривой Та =340 °С вверх, в сторону уменьшения температуры, величину отрезка = 1,2 мм.
Из полученной точки проводится горизонтальная проекция (показано на рис. 2.3) до пересечения с осью ординат.

Полученная точка будет соответствовать искомой величине показателя адиабаты сжатия k1=1,3775. Аналогично находят значения показателей адиабат сжатия для других расчетных режимов ДВС.
б) Средний показатель политропы сжатия
- для бензиновых двигателей n1=[(k1-0,00)-(k1-0,04)];
- для дизелей n1=[(k1+0,02)-(k1-0,02)].
в) Давление в конце сжатия, МПа:
 (2.26)
(2.26)
г) Температура в конце сжатия, К:
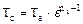 (2.27)
(2.27)
д) Средняя мольная теплоемкость в конце сжатия, кДж/(кмоль·град):
- свежей смеси (воздуха)  выбирается из таблицы 2.5. (Прим.: формулу средней мольной теплоемкости воздуха выбираем по таблице для температур 0…1500 °С).
выбирается из таблицы 2.5. (Прим.: формулу средней мольной теплоемкости воздуха выбираем по таблице для температур 0…1500 °С).
Таблица 2.5
| Наименование газа | Формулы для определения средней мольной теплоемкости отдельных газов при постоянном объеме, кДж/(кмоль×град) для температур, °С | |
| От 0 до 1500 | От 1501 до 2800 | |
| Воздух | mcv=20,6+0,002638×t | mcv=20,6+0,002638×t |
| О2 | mcvO2=20,93+0,004641×t-8,4×10-7×t2 | mcvO2=23,723+1,55×10-3×t |
| N2 | mcvN2=20,398+0,0025×t | mcvN2=21,951+1,457×10-3×t |
| H2 | mcvH2=20,684+2,06×10-4×t+5,88×10-7×t2 | mcvH2=23,723+1,55×10-3×t |
| CO | mcvCO=20,597+0,00267×t | mcvCO=22,49+0,00143×t |
| CO2 | mcvCO2=27,941+0,019×t-5,487×10-6×t2 | mcvCO2=39,123+3,349×10-3×t |
| H2O | mcvH2O=24,953+0,05359×t | mcvH2O=26,67+0,004438×t |
- остаточных газов  определяется методом интерполирования:
определяется методом интерполирования:
- для бензиновых ДВC по таблице 2.6;
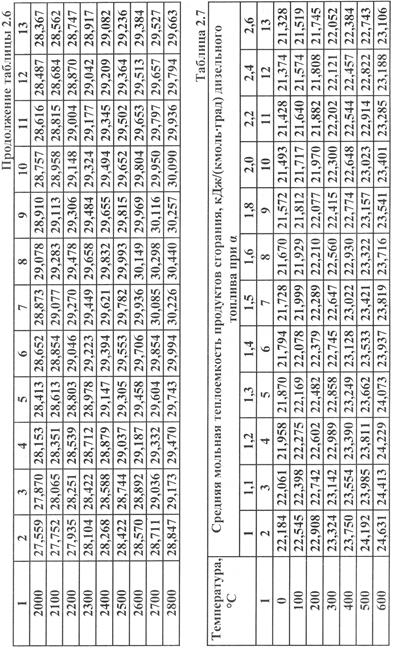
- для дизелей по таблице 2.7.
Методика определения средней мольной теплоемкости остаточных газов (ОГ), например, для карбюраторного ДВС при nN=5600 об/мин, α=0,96 и tc=482 °C следующая. Вначале делается интерполирование по коэффициенту избытка воздуха α.
Так как α=0,96 находится по таблице 2.6 между α=0,95 и α=1,00, то для этих значений коэффициента избытка воздуха по таблице находим средние мольные теплоемкости ОГ при tc=400 °C. Они равны, соответственно,  =23,586 и
=23,586 и  = 23,712. Далее интерполируем между этими значениями среднюю мольную теплоемкость ОГ для α=0,96. Очевидно, что для интервала 0,05 между рассматриваемыми значениями α будет соответствовать интервал между значениями теплоемкостей 23,712 и 23,586. Поэтому искомая теплоемкость ОГ для α=0,96 будет определяться как сумма теплоемкости для α=0,95 и теплоемкости, соответствующей приращению α на 0,01:
= 23,712. Далее интерполируем между этими значениями среднюю мольную теплоемкость ОГ для α=0,96. Очевидно, что для интервала 0,05 между рассматриваемыми значениями α будет соответствовать интервал между значениями теплоемкостей 23,712 и 23,586. Поэтому искомая теплоемкость ОГ для α=0,96 будет определяться как сумма теплоемкости для α=0,95 и теплоемкости, соответствующей приращению α на 0,01:

Можно определить и по другому – найти разность между теплоемкостью при α=1,00 и теплоемкостью, соответствующей приращению α на 0,04:

Аналогично, находится средняя мольная теплоемкость ОГ для α=0,96 и tc=500 °C. Она равна 24,041.
Далее, по такой же методике делается интерполирование теплоемкости ОГ по температуре tc:

- рабочей смеси:
 (2.28)
(2.28)

 |
Полученные результаты расчетов:
- для бензинового ДВС свести в таблицу 2.8;
- для дизеля представить в конце формул (2.26)…(2.28).
Таблица 2.8
Дата публикования: 2014-11-18; Прочитано: 2588 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
