 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Напрямок перебігу окисно – відновних реакцій
|
|
Реакція проходить самодовільно, якщо

Кожний з потенціалі відповідає певній рівновазі між окисненою та відновленою формами речовини, тому будь – яка з цих пар може бути як окисником, так і відновником.
Відновна здатність відновленої форми елемента тим вища, чим менше значення має електродний потенціал відповідної напівреакції.
Окислювальна здатність окисненої форми елемента тим вища, чим більше значення має електродний потенціал відповідної напівреакції.
Наприклад, потрібно визначити, чи можна іонами  окиснити металічну мідь за реакцією
окиснити металічну мідь за реакцією

В іонній формі

Записуємо загальну окисно – відновну реакцію у вигляді двох електронно – іонних напівреакцій, які відповідають окисненню відновника і відновленню окисника:

Розрахуємо ЕРС:
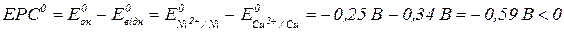
Отже, реакція не проходить самочинно.
Дата публикования: 2014-11-04; Прочитано: 2197 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
