 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теорія електролітичної дисоціації
|
|
У 1887 р. Арреніус запропонував теорію електролітичної дисоціації для пояснення причин утворення в розчинах електролітів більшого числа частинок порівняно з числом молекул, що розчиняються.
Суть теорії полягає в тому, що молекули електролітів під час розчинення у воді розкладаються на позитивно та негативно заряджені іони. При цьому суми позитивних і негативних зарядів є однаковими, тому розчини загалом залишаються електронейтральними.
Електролітична дисоціація – процес розщеплення електролітів на іони під дією полярних розчинників.
Внаслідок цього в розчині збільшується число частинок, що й зумовлює збільшення ізотонічного коефіцієнту.

На першій стадії полярні молекули гідратуються, внаслідок чого їхні зв’язки подовжуються і врешті вони розщеплюються на іони. Утворені іони перебувають у розчині в гідратованому стані.
Позитивно заряджені іони – катіони, негативно заряджені – аніони.
Фізичний зміст  : ізотонічний коефіцієнт показує, у скільки разів збільшується число частинок у розчинах електролітів внаслідок дисоціації.
: ізотонічний коефіцієнт показує, у скільки разів збільшується число частинок у розчинах електролітів внаслідок дисоціації.
Кількісна характеристика процесу дисоціації електролітів – ступінь електролітичної дисоціації.
Ступінь електролітичної дисоціації 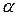 - це відношення числа молекул, які розщепилися на іони, до числа розчинених молекул:
- це відношення числа молекул, які розщепилися на іони, до числа розчинених молекул:

 - число молекул, які розщепилися на іони;
- число молекул, які розщепилися на іони;
 - число розчинених молекул.
- число розчинених молекул.
Тобто 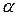 - це частка молекул електроліту, які розщепилися на іони.
- це частка молекул електроліту, які розщепилися на іони.  .
.
Ступінь дисоціації та ізотонічний коефіцієнт взаємозв’язані:
розглянемо розчин, який містить  молекул електроліту, кожна з яких може розщепитися на
молекул електроліту, кожна з яких може розщепитися на 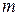 іонів. Число молекул, що розщепилися на іони
іонів. Число молекул, що розщепилися на іони  . Тоді число іонів у розчині становитиме
. Тоді число іонів у розчині становитиме  , а число недисоційованих молекул
, а число недисоційованих молекул
 .
.
Загальне число частинок (молекул та іонів) у розчині

Відношення загального числа частинок у розчині до числа розчинених молекул електроліту визначає ізотонічний коефіцієнт:

Тоді
Дата публикования: 2014-11-04; Прочитано: 969 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
