 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Іонний зв’язок
|
|
Сполуки з іонним типом зв’язку утворюються в результаті взаємодії елементів, атоми яких значно різняться електронегативністю.


Визначеної межі між іонним та ковалентним зв’язком не існує. Чисто іонний зв’язок може бути зображений простою електростатичною моделлю, відповідно якій тверді тіла можна розглядати як систему іонів.
Головна відзначна особливість твердих іонних сполук від ковалентних пов’язана з їх різними кристалічними гратками: в іонних кристалах у вузлах гратки знаходяться позитивно та негативно заряджені іони (на відміну від атомів або молекул у вузлах ковалентних кристалів). Іони в вузлах іонного кристалу розташовані так, що сили притягання між різно зарядженими іонами максимальні, а сили відштовхування між однаково зарядженими іонами мінімальні.
Процеси перетворення атомів на іони виявляються енергетично вигідними тоді, коли атом, що віддає електрони, має низьку енергію іонізації, а атом, що приєднує електрон, - велику спорідненість до електрона.
В основу іонного зв’язку покладено електростатичну взаємодію між іонами, тому, на відміну від ковалентного, іонний зв’язок характеризується ненапрямленістю і ненасиченістю.
Ненапрямленість зумовлена тим, що електричне поле кожного іона, який уявно можна розглядати як заряджену сферу, посилюється у просторі в усіх напрямках.
Ненасиченість пов’язана з тим, що в результаті взаємодії двох протилежно заряджених іонів їхні електричні поля компенсуються не повністю, тому можливе притягання цих іонів в інших напрямках.
У результаті кожний іон оточує себе іонами протилежного заряду.

Сполуки з іонним типом зв’язку у вигляді молекул не існують ні в твердому стані (іонна кристалічна гратка), ні в розчині (дисоціюють на іони під впливом полярних молекул розчинника). Нестійкі молекули іонних сполук можна виявити тільки в газовому стані за високих температур.
Основні властивості іонних сполук:
1. низька електрична провідність в твердому стані, але висока провідність у розплавах. Електрична провідність пояснюється існуванням у цих речовинах іонів, які вільно рухаються під дією електричного поля. У твердому стані іони у вузлах кристалічної гратки закріплені та пересуватися не можуть.
2. високі температури плавлення. Іонні зв’язки дуже міцні та ненапрямлені.
3. твердість, але крихкість. Твердість обумовлена неможливістю утворення кратних зв’язків внаслідок розділення іонів у просторі та відсутності теплового руху іонів. Крихкість пояснюється природою іонного зв’язку: навіть за відносно невеликого зсуву іонів виникають контакти аніон – аніон та катіон – катіон та замість сил притягання з’являються сили відштовхування. Внаслідок цього кристал розколюється.
4. помітно розчинні у полярних розчинниках з високою діелектричною проникністю.
Енергія взаємодії двох заряджених частинок в будь-якому середовищі:

 - заряди іонів;
- заряди іонів;
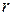 - відстань між частинками;
- відстань між частинками;
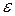 - діелектрична проникність середовища.
- діелектрична проникність середовища.
Вакуум: 
 .
.
Вода:  .
.
Аміак:  .
.
Дата публикования: 2014-11-04; Прочитано: 530 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
