 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Рассмотрим сперва механизм образования ДЭС коллоидной частицы адсорбционным путем
|
|
В качестве примера возьмем золь, полученный с помощью метода химической агрегации в результате смешивания истинных растворов двух веществ: нитрата серебра и иодида калия
AgNO3 + KI = KNO3 + AgI ↓ молекулярное уравнений реакции
Ag+ + I– = AgI ↓ сокращенное ионное уравнение реакции
Как следует из уравнения реакции, частицы дисперсной фазы в данном золе образуются за счет связывания друг с другом ионов Ag+ и I–.
В зависимости от молярного соотношения исходных веществ возможны два конечных результата.
1. Исходные вещества взяты в стехиометрическом соотношении, т.е. n(AgNO3) = n(KI).
В этом случае ионы Ag+ и I– присутствуют в равных количествах и поэтому принимают одинаковое участие в построении кристаллической решетки частиц осадка, встраиваясь в нее практически одновременно

При этом частицы дисперсной фазы на протяжении всего этапа своего роста будут оставаться электронейтральными, их размеры со временем превысят размеры коллоидных частиц (> 10–7 м). За счет действия силы тяжести и процесса агрегации (т.е. слипания частиц друг с другом) вещество дисперсной фазы в итоге выпадает в осадок и образования золя не произойдет.
2. Для получения золя в данном случае одно из исходных веществ необходимо взять в избытке. Оно будет играть роль стабилизатора и позволит ограничить, а затем и полностью прекратить увеличение размеров частиц дисперсной фазы, сохраняя их в пределах 10–9÷10–7 м. Рассмотрим механизм данного процесса более подробно. Для этого предположим, что в избытке взяли нитрат серебра (AgNO3).
Значит, концентрация ионов Ag+ в растворе будет больше, чем концентрация иодид-ионов (I–). Это приведет к тому, что в процессе роста ядра мицеллы достраивание его кристаллической решетки будет осуществляться в первую очередь за счет ионов Ag+. Они, прочно входя в структуру ионной решетки, станут накапливаться на поверхности частицы (агрегата), сообщая ей положительный электрический заряд

Ионы I– при этом всегда будут запаздывать, т.к. их содержание в растворе гораздо меньше, по сравнению с ионами Ag+.
Вокруг заряженной частицы возникнет электрическое поле, количественно характеризующееся так называемым электротермодинамическим или поверхностным потенциалом (сокращенно – Е-потенциалом).
Величина Е-потенциала прямо пропорциональна заряду частицы, который, в свою очередь, определяется числом избыточных ионов Ag+, расположенных на поверхности агрегата или ядра. В связи с этим, ионы Ag+ называются иначе потенциалопределяющими ионами.
Согласно правилу Панетта-Фаянса, в роли потенциалопределяющих ионов при образовании коллоидной частицы в первую очередь выступают те ионы, которые входят в состав ее кристаллической решетки или имеют с ними общую группу атомов (например, ионы НСО3– при образовании кристалла СаСО3) и присутствуют в избыточном количестве.
Величина поверхностного потенциала у многих коллоидных частиц достигает 1 В. Частицы с таким относительно большим зарядом будут активно притягивать к себе из раствора противоположно заряженные ионы (называемые поэтому противоионами).
В нашем случае это будут преимущественно NО3–-ионы, т.к. их в растворе, наряду с ионами Ag+, содержится избыточное количество. Но эти ионы, в отличие от ионов I–, не могут встраиваться в кристаллическую решетку частиц осадка. В связи с этим, часть из них прочно и неподвижно закрепится на поверхности ядра за счет действия электростатических и адсорбционных сил, образуя с потенциалопределяющими ионами адсорбционный слой мицеллы. Другая часть, связанная с ядром только кулоновскими силами, под влиянием теплового движения десорбируется с поверхности частицы и расположится в прилегающей к ней жидкой фазе, образуя так называемый диффузный слой. Диффузный слой размыт, не имеет четких границ, и концентрация противоионов в нем уменьшается по мере удаления от поверхности частицы (рис. 59).
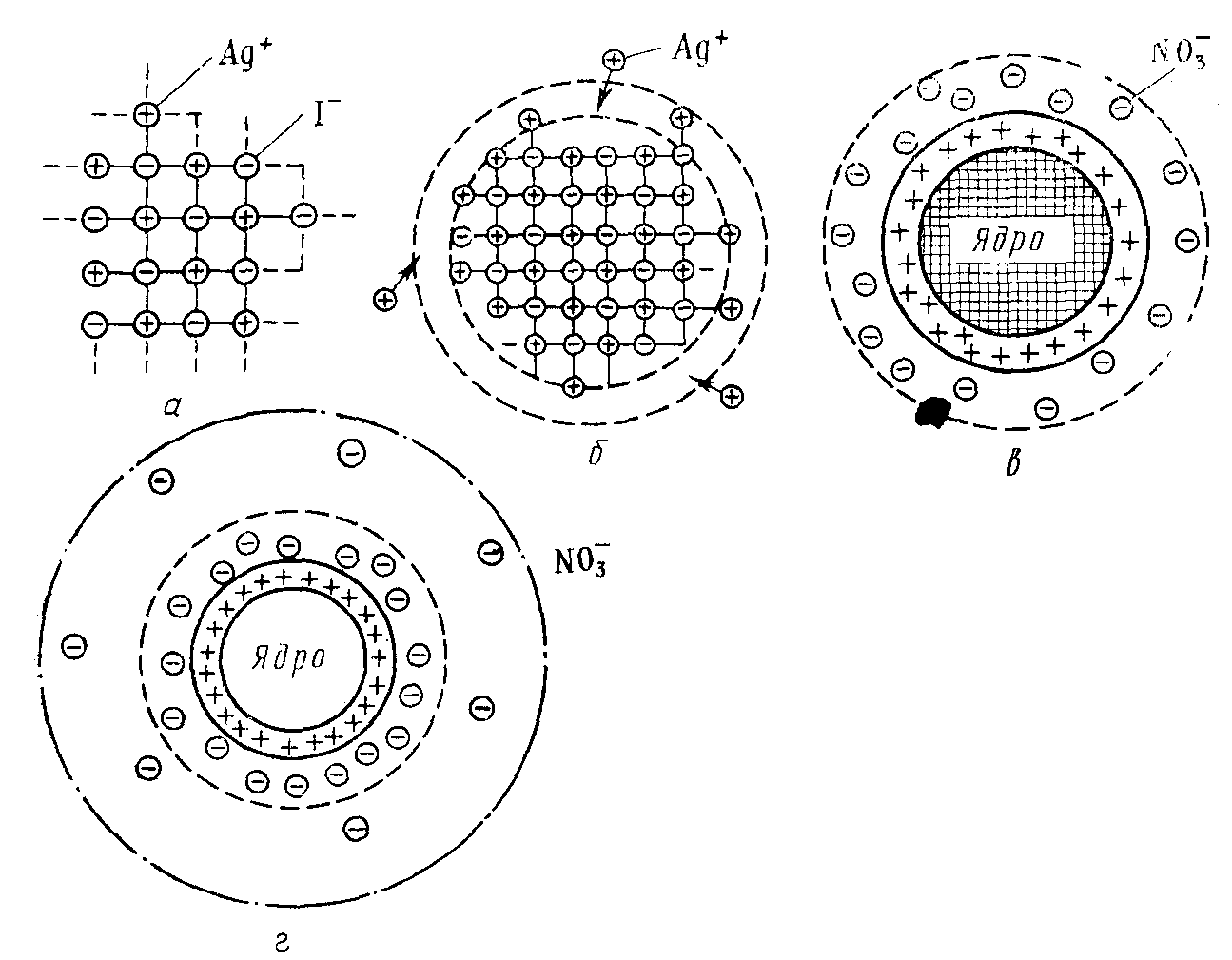
Рис. 59. Схема постепенного образования мицеллы гидрозоля АgI:
а – ультрамикрокристалл АgI; б – достраивание микрокристалла ядра за счет избирательной адсорбции из раствора ионов Аg+ (стадия образования адсорбционного слоя); в – образование гранулы (завершение образования адсорбционного слоя); г – образование мицеллы и диффузного слоя
Суммарный заряд всех противоионов (как адсорбированных на поверхности ядра, так и удерживаемых в диффузном слое) равен по абсолютной величине, но противоположен по знаку суммарному заряду потенциалопределяющих ионов.
Ядро вместе с адсорбционным слоем составляет твердую часть частицы – гранулу. Она имеет заряд, совпадающий по знаку с зарядом потенциалопределяющих ионов, но меньший по абсолютной величине. Соответственно, и потенциал гранулы также будет меньше Е-потенциала частицы в зависимости от количества противоионов в адсорбционном слое. Потенциал гранулы называется электрокинетическим или дзета-потенциалом (ζ-потенциал). Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц во внешнем электрическом слое. Его можно определить так же, как потенциал, на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями.
Гранула вместе с диффузным слоем и составляет коллоидную частицу – мицеллу, которая всегда остается электронейтральной, т.к. заряды гранулы и диффузного слоя совпадают по абсолютной величине, но противоположны по знаку.
Чем больше противоионов находится в диффузном слое мицеллы, тем заряд гранулы и ζ-потенциал выше. Если же все противоионы переместятся под действием внешних факторов из диффузного слоя в адсорбционный, то заряд гранулы и его электрокинетический потенциал, наоборот, станут равны нулю.
Строение и состав мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. В этих формулах ядро заключается в квадратные скобки, а гранулы – в фигурные. Формула мицеллы AgI с учетом вышесказанного будет выглядеть следующим образом:
| { | m[AgI] | · | n Ag+ (n – x)NO3– | }+x | xNO3– | |
| агрегат или ядро | адсорбционный слой | диффузный слой | ||||
| гранула | ||||||
| мицелла |
где m – число молекул или формульных единиц, входящих в состав кристаллической решетки ядра; n – число избыточных потенциалопределяющих ионов, расположенных на поверхности ядра (m > n).
Если при получении золя AgI в избытке взять KI, то потенциалопределяющими ионами будут являться ионы I–, а противоионами – K+. В этом случае формула мицеллы запишется следующим образом:
{m[AgI]nI– (n – x) K+}–x хK+
Таким образом, в зависимости от условий получения золя гранулы его мицелл могут быть заряжены как положительно, так и отрицательно.
В некоторых литературных источниках составные части мицеллы обозначаются немного иначе. Агрегатом называют электронейтральную часть коллоидной частицы, а ядром – агрегат вместе с расположенными на его поверхности потенциалопределяющими ионами. В состав адсорбционного слоя при этом включают только прочно удерживаемые на поверхности ядра противоионы:
| { | m[AgI] | n Ag+ | (n – x)NO3– | }+х | xNO3– | |
| агрегат | адсорбционный слой | диффузный слой | ||||
| ядро | ||||||
| гранула | ||||||
| мицелла |
Принципиальной разницы эти 2 способа обозначения составных частей мицеллы не имеют. Поэтому в дальнейшем мы будем придерживаться первого способа.
Рассмотрим более сложные случаи приготовления золей методом химической агрегации и запишем формулы образующихся при этом мицелл.
1. Получение золя берлинской лазури:
3 K4 [Fe(CN)6] + 4 FeCl3 → Fe4 [Fe(CN)6]3↓ + 12 KCl
Если в избытке взять комплексную соль K4 [Fe(CN)6], то потенциалопределяющими ионами будут являться ионы [Fe(CN)6]4–, а противоионами – K+. Гранула в этом случае будет иметь отрицательный заряд:
{m[Fe4[Fe(CN)6]3]n[Fe(CN)6]4– (4n – x) K+}–x xK+
При получении данного золя в условиях избытка FeCl3 потенциалопределяющими ионами станут ионы Fe3+, а противоионами – Cl–. Гранула при этом приобретет положительный заряд:
{m[Fe4[Fe(CN)6]3]nFe3+ (3n – x) Cl–}+x xCl–
2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
FeCl3 + 3 H2O  Fe(OH)3↓ + 3HCl
Fe(OH)3↓ + 3HCl
Часть образовавшегося Fe(OH)3 в условиях проведения реакции прореагирует с соляной кислотой:
Fe(OH)3 + HCl → FeOCl + 2 H2O
В связи с этим в роли стабилизатора будет выступать FeOCl:
FeOCl ↔ FeO+ + Cl–
т.к. хлорид железа(III) расходуется полностью, то потенциалопределяющими будут являться ионы FeO+, т.к. именно они, а не ионы Fe3+, станут присутствовать в растворе в избытке.
Формула мицеллы (рис. 60а) при этом запишется следующим образом:
{m[Fe(OH)3] · nFeO+ (n – x) Cl–}+x xCl–
3. Получение золя As2S3:
2H3AsO3 + 3H2S → As2S3 ↓ + 6 H2O
избыток
Двухосновная сероводородная кислота является слабым электролитом, в растворе диссоциирует преимущественно по первой стадии
H2S ↔ HS– + H+,
поэтому потенциалопределяющими ионами в данном случае будут выступать ионы HS–. В связи с этим формулу образовавшейся мицеллы (рис. 60б) можно представить следующим образом:
{m[As2S3]n HS–(n – x) H+}–x xH+

Рис. 60. Схема строения: a – мицеллы гидроксида железа (III);
б – мицеллы сульфида мышьяка m – число молекул, образующих ядро; δ – адсорбционный слой (плотный); Q – диффузный слой противоионов
В качестве примера образования ДЭС путем поверхностной диссоциации можно рассмотреть строение мицеллы кремниевой кислоты, часть молекул которой, находясь на поверхности ядра, диссоциирует по уравнению:
H2SiO3 ↔ H+ + HSiO3–
Причем ионы HSiO3–, прочно связанные с ядром, являются потенциалопределяющими. Роль противоионов выполняют подвижные ионы Н+, которые распределяются как в адсорбционном, так и в диффузном слоях (рис. 61). Схематическое строение коллоидной частицы данного золя можно представить следующим образом:
{m[H2SiO3]n HSiO3– (n – x) H+} xH+
Рис. 61. Диссоциация поверхностных силанольных групп
Следует отметить, что мицеллы в золях не имеют строго определенного состава и обладают более сложным строением, которое предложенные нами формулы отражают со значительной степенью условности. Тем не менее, они позволяют интерпретировать многие свойства золей как в качественном, так и в количественном плане, и поэтому представляют определенный интерес.
Дата публикования: 2014-11-03; Прочитано: 3039 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
