 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические свойства природных газов и конденсата
|
|
Редакторы: Н.А. Заходякина
Р.Г. Чиркова
Компьютерная верстка В.О. Терехова
Подписано в печать 01.02.05. Формат 60х841/16. Бумага SvetoCopy. Отпечатано на ризографе. Усл. печ. л. 5,11. Уч.-изд. л. 6,1. Тираж 100 экз. Заказ
Российский химико-технологический университет им. Д.И. Менделеева
Издательский центр
Адрес университета и издательского центра: 125047, Москва, Миусская пл., 9
Физико-химические свойства природных газов и конденсата
Добываемые на газовых, газоконденсатных, газонефтяных месторождениях природные газы представляют собой многокомпонентные системы, состоящие из предельных углеводородов и некоторых неуглеводородных соединений. Предельные углеводороды имеют формулу СnН2n+2 и в нормальных условиях представляют собою газы (в молекуле до 4 атомов углерода - от СН4 до С4Н10), жидкости (в молекуле до 26 атомов углерода), твёрдые (в молекуле более 26 атомов углерода). Тяжёлые УВ в зависимости от температуры и давления могут быть растворены в более лёгких. Из неуглеводородных соединений природные газы содержат N2, C02, H2S и др., а также инертные: Не, Ar, Cr, Xe, Ne. Как правило, природные газы насыщены парами воды, количество которых зависит от Т°, P и состава газа и самой воды.
Углеводороды, входящие в состав природных газов, имеют различные физические свойства (таблица 1).
Таблица 1 Основные параметры компонентов природного газа.
| Показатели | Компоненты | ||||||
| СН4 | С2Н6 | С3Н8 | n-C4H10 | i-C4H10 | n-C5H12 | i-C5H12 | |
| Молекулярная масса | 16,042 | 30,068 | 44,094 | 58,120 | 58,120 | 72,151 | 72,151 |
| Молекулярный объем при 0 °С и 760мм рт. ст. | 22,36 | 22,16 | 21,82 | 21,50 | 21,75 | 20,87 | 20,87 |
| Плотность при 0 °С и 760 кПа, кг/м3 | 0,7168 | 1,356 | 2,010 | 2,703 | 2,668 | 3,457 | 3,457 |
| Плотность при 20 °С и 760 кПа, кг/м3 | 0,6679 | 1,263 | 1,872 | 2,5185 | 2,4859 | 3,221 | 3,221 |
| Относительная плотность (по воздуху) | 0,555 | 1,049 | 1,562 | 2,091 | 2,067 | 2,674 | 2,490 |
| Газовая постоянная, м/°С | 52,95 | 28,19 | 19,23 | 14,95 | 14,95 | 11,75 | 11,75 |
| Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. | 0,5172 0,3936 | 0,3934 0,3273 | 0,3701 0,3252 | 0,3802 0,3466 | 0,3802 0,3465 | 0,3805 0,3533 | 0,3805 0,3533 |
| Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 | 1,0484 | 0,8720 | 0,7649 | 0,6956 | 0,7027 | 0,6354 | 0,6507 |
| Фактор ацентричности молекул, ω | 0,0104 | 0,0986 | 0,1524 | 0,0201 | 0,1849 | 0,2539 | 0,2223 |
| Параметры потенциалов: | |||||||
| ε/k, К | 140,0 | 236,0 | 206,0 | 208,0 | 217,0 | 269,0 | 269,0 |
Продолжение таблицы 1
| δ, А° | 3,808 | 4,384 | 5,420 | 5,869 | 5,819 | 0,099 | 6,057 |
| δ безр. | - | - | - | - | - | - | - |
| Критическая температура Ткр, К° | 190,55 | 305,43 | 369,82 | 425,16 | 408,13 | 469,65 | 460,39 |
| Критическое давление Ркр, кПа·100 | 46,95 | 49,76 | 43,33 | 38,71 | 37,19 | 34,35 | 34,48 |
| Температура кипения Ткип , К° | 111,7 | 184,6 | 231,1 | 272,7 | 261,5 | 309,3 | 301,0 |
| Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. | 0,026 | 0,016 | 0,013 | 0,011 | 0,010 | 0,0106 | 0,0106 |
| С6Н14 | С7Н16 | С8Н18 | N2 | H12 | Воздух | ||
| Молекулярная масса | 86,178 | 100,198 | 114,22 | 28,016 | 2,016 | 28,96 | |
| Молекулярный объем при 0 °С и 760мм рт. ст. | 22,42 | 22,47 | 22,71 | 22,404 | 22,43 | 22,4 | |
| Плотность при 0 °С и 760 кПа, кг/м3 | 3,845 | 4,459 | 5,030 | 1,2503 | 0,0899 | 1,2928 | |
| Плотность при 20 °С и 760 кПа, кг/м3 | 3,583 | 4,155 | 4,687 | 1,1651 | 0,0837 | 1,2046 | |
| Относительная плотность (по воздуху) | 2,974 | 3,450 | 3,820 | 0,967 | 0,069 | 1,000 | |
| Газовая постоянная, м/°С | 9,84 | 8,46 | 7,42 | 30,26 | 420,63 | 29,27 | |
| Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. | 0,3827 0,3600 | 0,3846 0,3652 | 0,3856 0,3686 | 0,2482 0,1770 | 3,3904 2,4045 | 0,2397 0,1712 | |
| Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 | 0,6169 | 0,5500 | 0,5030 | 1,6981 | 0,8984 | 1,7419 | |
| Фактор ацентричности молекул, ω | 0,3007 | 0,3498 | 0,4018 | 0,040 | - | ||
| Параметры потенциалов: | |||||||
| ε/k, К | 423,0 | 288,0 | 333,0 | 91,5 | 33,3 | 78,6 | |
| δ, А° | 5,916 | 7,000 | 7,407 | 3,681 | 2,968 | 3,711 | |
| δ безр. | - | - | - | - | |||
| Критическая температура Ткр, К° | 507,35 | 540,15 | 568,76 | 126,26 | 33,25 | 37,2 | |
| Критическое давление Ркр, кПа·100 | 30,72 | 27,90 | 25,35 | 34,65 | 13,25 | 132,4 | |
| Температура кипения Ткип К° | 341,9 | 371,6 | 398,9 | 77,3 | 20,4 | 78,8 | |
| Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. | 0,00966 | 0,0092 | 0,0084 | 0,020 | 0,148 | 0,021 |
Продолжение таблицы 1
| Водяной пар | О2 | H2S | SO2 | CO2 | CO | NO2 | NO | ||
| Молекулярная масса | 18,016 | 32,0 | 34,082 | 64,06 | 44,011 | 28,011 | 46,006 | 30,01 | |
| Молекулярный объем при 0 °С и 760мм рт. ст. | 23,45 | - | 22,14 | - | 22,26 | 22,41 | - | - | |
| Плотность при 0 °С и 760 кПа, кг/м3 | 1,8041 | 1,429 | 1,539 | 2,927 | 1,977 | 1,250 | 2,055 | 1,340 | |
| Плотность при 20 °С и 760 кПа, кг/м3 | 0,7496 | 1,3315 | 1,434 | 2,727 | 1,842 | 1,165 | 1,915 | 1,249 | |
| Относительная плотность (по воздуху) | 0,624 | 1,105 | 1,190 | 2,264 | 1,529 | 0,967 | 1,593 | 1,037 | |
| Газовая постоянная, м/°С | 47,06 | 26,47 | 24,89 | - | 19,27 | 30,26 | - | - | |
| Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. | 0,4441 0,3469 | 0,2185 0,156 | 0,253 0,192 | - | 0,1946 0,1496 | 0,2483 0,1774 | - | - | |
| Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 | 0,9006 | 1,948 | 1,2025 | 1,1804 | 1,3942 | 1,6951 | - | 1,8358 | |
| Фактор ацентричности молекул, ω | - | 0,019 | 0,100 | 0,598 | 0,231 | - | 0,093 | - | |
| Параметры потенциалов: | |||||||||
| ε/k, К | - | ||||||||
| δ, А° | - | 3,541 | 3,49 | 4,04 | 3,996 | 3,590 | 3,879 | 3,470 | |
| δ безр. | - | 0,21 | 0,42 | - | - | - | |||
| Критическая температура Ткр, К° | - | 154,78 | 373,6 | 430,65 | 304,2 | 132,93 | 180,3 | ||
| Критическое давление Ркр, кПа·100 | - | 51,8 | 91,85 | 80,49 | 75,27 | 35,27 | 431,0 | 66,64 | |
| Температура кипения Ткип, К | - | 211,4 | 263,2 | 194,7 | 81,7 | 294,5 | 121,4 | ||
| Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. | 0,015 | - | 0,011 | - | 0,012 | - | - | - | |
| He | Ar | Kr | Fr | Cl2 | Этил-меркаптан C2H5SH | H2O | Hg | ||
| Молекулярная масса | 4,00 | 39,95 | 83,80 | 38,00 | 70,91 | 62,13 | 18,02 | 200,59 | |
| Молекулярный объем при 0 °С и 760мм рт. ст. | - | - | - | - | - | - | - | 18,019 | |
Продолжение таблицы 1
| He | Ar | Kr | Fr | Cl2 | Этил-меркаптан C2H5SH | H2O | Hg | ||
| Плотность при 0 °С и 760 кПа, кг/м3 | 0,178 | 1,784 | - | - | 3,233 | 0,84 | - | 13 595 | |
| Плотность при 20 °С и 760 кПа, кг/м3 | 0,166 | 1,1662 | - | - | 3,012 | - | 998,2 | 13 546 | |
| Относительная плотность (по воздуху) | 1,138 | 1,380 | - | 2,501 | |||||
| Газовая постоянная, м/°С | 211,84 | - | - | - | |||||
| Теплоемкость при 0 °С и 760мм рт. ст., Cp/Cv, 4,1868·103 Дж/кг·град. | 1,260 0,760 | 1,2430 - | - | - | - | - | 1,0074 - | 0,0335 - | |
| Коэффициент динамической вязкости при 20 °С и 760мм рт. ст, 10-6 кг·с/м2 | 1,8970 | 2,1265 | 2,3764 | - | 1,2698 | - | 1,004 | - | |
| Фактор ацентричности молекул, ω | 0,246 | - | 0,002 | 0,071 | 0,082 | - | 0,348 | - | |
| Параметры потенциалов: | |||||||||
| ε/k, К | 10,8 | 124,9 | 166,7 | 112,0 | 357,0 | 447,6 | 775,0 | - | |
| δ, А° | 2,57 | 3,423 | 3,679 | 3,653 | 4,117 | 4,644 | 2,52 | - | |
| δ безр. | - | - | 0,156 | 1,0 | - | ||||
| Критическая температура Ткр, К° | 5,2 | 150,72 | 309,41 | 144,2 | 417,2 | 647,4 | - | ||
| Критическое давление Ркр, кПа·100 | 2,34 | 49,59 | 56,0 | 56,83 | 78,63 | 56,0 | 225,55 | - | |
| Температура кипения Ткип К | 4,3 | 87,5 | 121,4 | 86,2 | 238,6 | - | 373,2 | - | |
| Теплопроводность при 0 °С и 760мм рт. ст., 1,163 вт/м2·град. | 0,123 | - | - | - | - | - | - | - | |
В зависимости от количества лёгких или тяжёлых (С3Н8 + С4Н10) газ делится на сухой и жирный. Сухой газ без тяжелых УВ или содержит его очень мало. Жирный газ содержит тяжелые УВ или газовый бензин (конденсат).
При разработке УВ залежей (месторождений) всегда сталкиваемся с законами изменения состояния газов как многокомпонентных систем. Основные законы: 1) Бойля-Мариота; 2) Гей-Люссака; 3) Авогадро; 4) Клапейрона - Менделеева.
1) Закон Бойля-Мариота - при изотермическом сжатии удельный объем идеального газа изменяется обратно пропорционально давлению  и P1V1= P2V2.
и P1V1= P2V2.
2) Закон Гей-Люссака - удельный объем идеального газа при постоянном давлении увеличивается при повышении температуры VT = V0(1 + aVt). Vo - начальный объем газа при Т=0 С0, VT - объем газа при температуре t С0, aV - температурный коэффициент объемного расширения = 0,0036604. При V=const с ростом Т° повышается давление газа PT = P0(1 + aТТ). Для идеального газа aV = аТ. При Р=const можно написать  и при V=const
и при V=const  , где Т- термодинамическая температура T=273,16+t С°.
, где Т- термодинамическая температура T=273,16+t С°.
3) Закон Авогадро - равные объемы идеальных газов при одинаковых Р и Т содержат одинаковое число молекул (N=6,02·1026K· моль-1), т.е.  , т.е плотности газов ρ1и ρ2 пропорциональны их молекулярным массам М1 и М2. Или
, т.е плотности газов ρ1и ρ2 пропорциональны их молекулярным массам М1 и М2. Или 
 при 0 С° и 101,325 кПа (1 атм.=760мм, рт. ст.) молярный объем газа = 22,4136 м³/К·моль. Тогда
при 0 С° и 101,325 кПа (1 атм.=760мм, рт. ст.) молярный объем газа = 22,4136 м³/К·моль. Тогда  кг/ м³.
кг/ м³.
4) Закон Менделеева-Клапейрона для идеальных газов PV=vRT, где Р - давление в Па, V - объем газа в м³, v-количество газа в К·моль, R - универсальная газовая постоянная (R=8,31434·103 Дж/к·моль0·К). Этот закон для низких давлений. Для реальных газов используют уравнение Ван-дер-Ваальса, Битти-Бриджмена и др.
Основные физические свойства газа и конденсата: плотность кг/м³ или г/см³; давление в атмосферах, мПа, Па; температура в С0 и К0; вязкость пуаз, спуаз, кг·с/см²; коэффициент сверхсжимаемости газа; влагосодержание газа г/м³; теплоемкость Дж/кг·С°, ккал/кг·С°.
1.1. Плотность газа - масса единицы объема газа. Плотность газа известного состава определяется как сумма произведений плотности отдельных компонентов на их объемное (молярное содержание),  или по известным молекулярным массам
или по известным молекулярным массам 
Плотность сухого газа при Т0 и Р определяется  где ρн – плотность при 20 Сº и 760мм рт. ст, кг/м³; z -коэффициент сверхсжимаемости газа при Р и Т0. Если в газе пары воды, плотность его равна
где ρн – плотность при 20 Сº и 760мм рт. ст, кг/м³; z -коэффициент сверхсжимаемости газа при Р и Т0. Если в газе пары воды, плотность его равна  , где W – влагосодержание; ρв.п - плотность насыщенного водяного пара, кг/м³; Pв.п. - давление насыщенного водяного пара, кг/см².
, где W – влагосодержание; ρв.п - плотность насыщенного водяного пара, кг/м³; Pв.п. - давление насыщенного водяного пара, кг/см².
В газоконденсатных скважинах плотность смеси определяется по формуле:  где ρ и ρk - плотность газа и конденсата после сепаратора при 20 С0 и 760мм. рт. ст. кг/м³; Qr, Qk - дебиты газа и конденсата при 20 С0 и 760мм. рт. ст., м³/сутки, При тех же условиях
где ρ и ρk - плотность газа и конденсата после сепаратора при 20 С0 и 760мм. рт. ст. кг/м³; Qr, Qk - дебиты газа и конденсата при 20 С0 и 760мм. рт. ст., м³/сутки, При тех же условиях  кажущийся объемный коэффициент конденсата, Mk -молярная масса конденсата.
кажущийся объемный коэффициент конденсата, Mk -молярная масса конденсата.
Пример. Рассчитать плотность газа при Р=15,0·мПа и T=30ºC.
Таблица 2 Расчет плотности газа
| Состав газа | %, Xi | Pi | PiXi | ω | Xiω1 |
| СН4 | 74,1 | 0,6679 | 0,4949 | 0,0104 | 0,007710 |
| С2Н6 | 7,48 | 1,2630 | 0,0964 | 0,0986 | 0,007375 |
| С3Н8 | 3,37 | 1,872 | 0,0630 | 0,1524 | 0,005135 |
| iС4Н10 | 0,76 | 2,4859 | 0,0188 | 0,1849 | 0,001405 |
| С4Н10 | 1,68 | 2,5185 | 0,0423 | 0,1010 | 0,003376 |
| iС5Н12 | 0,57 | 3,221 | 0,0183 | 0,2223 | 0,001267 |
| С5Н12 | 0,32 | 3,221 | 0,0183 | 0,2539 | 0,000812 |
| С6Н14 | 0,63 | 3,583 | 0,0225 | 0,3007 | 0,001894 |
| N2 | 6,09 | 1,1651 | 0,0709 | 0,0400 | 0,002436 |
| H2S | 2,0 | 1,434 | 0,0286 | 0,1200 | 0,002000 |
| C02 | 3,0 | 1,542 | 0,0552 | 0,3310 | 0,006930 |
| Сумма | 100=∑Xi | 0,9192=∑PiXi=ρн | ∑=0,04034 |
∑PiXi=0,9192кг/м³  - относительный удельный вес (по воздуху).
- относительный удельный вес (по воздуху).
По формуле 
 кг/м³, приняли z=1.
кг/м³, приняли z=1.
Пример. Определить плотность ГКС (газоконденсатной смеси) при рг=0,723 кг/м³; ( =0,6); рк=740 кг/м³, содержащего конденсата в газе 300см³/м³. Qг=200тыс м³/сутки. Молекулярная масса конденсата М=149 кг/к.моль.
=0,6); рк=740 кг/м³, содержащего конденсата в газе 300см³/м³. Qг=200тыс м³/сутки. Молекулярная масса конденсата М=149 кг/к.моль.
1) Суточный дебит конденсата Qк =0,3·10-3·200·103=60м³/сут.
2) По формуле 
3) По формуле  г/см³.
г/см³.
1.2. Давление - измеряемое в соответствующих условиях, мПа, Па, кг/см².
1.3. Температура - по Цельсию в С0 и термодинамическая - К = 273 + С0.
1.4. Вязкость - свойство сопротивляться перемещению одних частиц относительно других. Зависит от температуры и давления. Это сила сдвига на ед. площади, отсюда ее размерность - сила·время/длина². Или масса/длина·время. Более распространена пуаз и сантипуаз. Расчет ее проводят в 2 этапа - сначала при заданной Т° и Ратм; затем полученное значение пересчитывают на заданное давление. Графическим и аналитическим методом.
1.5. Коэффициент сверхжимаемости газа - функция давления, температуры и состава газа. Его определяют, исходя из состава газа. В инженерных расчетах чаще пользуются обобщенным уравнением Менделеева-Клапейрона, в которое вводится коэффициент сверхсжимаемости, учитывающий отклонение реальных газов от идеальных. PV=zRT. Заменив уд. объем на плотность газа получим P=pzRT. z-коэффициент сверхжимаемости газа; R - газовая постоянная, м/ С0. Критическое состояние вещества, при котором плотность его и насыщенного пара этого вещества равны друг другу. Параметры, соответствующие этому состоянию, называются критическими параметрами. Для природного газа, являющегося смесью УВ и неУВ компонентов, критические параметры определяются как псевдокритические по составу газа. Когда в газе меньше 10% объема высококипящих УВ и неУВ компонентов, псевдокритические параметры определяются по формулам: 
 , где pп.кр – псевдокритическое давление газа, кгс/см²; Tп.кр – псевдокритическая, К; pкр, Tкр – критические давление, температура i-го компонента, определяемое по таблицам (см. таблицу 1); x i – молярное (объемное) содержание i-го компонента.
, где pп.кр – псевдокритическое давление газа, кгс/см²; Tп.кр – псевдокритическая, К; pкр, Tкр – критические давление, температура i-го компонента, определяемое по таблицам (см. таблицу 1); x i – молярное (объемное) содержание i-го компонента.
В том случае, когда компонентный состав газа неизвестен, псевдокритические параметры можно определить по относительной плотности газа (рис. 2а, 2б). При наличии в газе азота, сероводорода и углекислого газа в псевдокритические параметры вводятся поправки с соответствующим знаком.
Приведенными параметрами называются отношения соответствующих параметров к их критическим значениям pпр=p/pкр, Тпр=Т/Ткр.
Критические и приведенные параметры позволяют использовать принцип соответственных состояний для определения коэффициента сверхсжимаемости, вязкости и некоторых других характеристик газа.
Принцип соответственных состояний заключается в том, что если два или несколько веществ, удовлетворяющих одному и тому же приведенному уравнению состояния, имеют одинаковые два из трех приведенных параметров, то и третий приведенный параметр будет у них также одинаков. Так как в критической точке приведенные параметры одинаковы и равны единице, критические состояния всех веществ являются соответственными.
Пример. Определить z газа при Р=150 атм. и Т=303 К, состав которого в таблице 2. Tкр=218,4, Ркр=47,6. Определяем  ,
,  По графику z=0,7. Порядок определения z (по двум параметрам):
По графику z=0,7. Порядок определения z (по двум параметрам):
1. Находят критические параметры Ркр и Ткр
2. Рассматривают приведенные параметры Рпр и Тпр
3. По графикам определяют для рассчитанных pпр и Тпр. коэффициент z.

Рисунок 1. Зависимость коэффициента сверхсжимаемости для природного газа от приведенного давления и температуры

Рисунок 2. График для определения коэффициента сжимаемости z(0) простых веществ

Рисунок 2а. Псевдокритические давления (а) и температуры (б) природных газов
1 – углеводородные газы; 2 – смесь газов; 3 – продукция газоконденсатных скважин.

Содержание неуглеводородного компонента, об.%
Рисунок 2б. Поправки к псевдокритическим давлениям (а) и температурам (б), определяемым по рис. 2а для газов, содержащих примеси
Примесь: 1 – H2S; 2 - СO2; 3 - N2
Пример. Предыдущий газ. Рассчитываем фактор ацентричности по ω=0,04034 (табл. 2), по формуле  .
.
Порядок определения z по 3 параметрам, когда в газе суммарная молярная концентрация высококипящих УВ и неУВ компонентов превышает 10%. 3-ий параметр и есть фактор ацентричности ω молекул, который для смеси определяется по формуле:  (табл2.). Коэффициент z по 3 параметрам, определяется по формуле
(табл2.). Коэффициент z по 3 параметрам, определяется по формуле  .
.
 и
и  в зависимости от pпр и Тпр.находят по графикам. Естъ аналитические методы определения коэффициента сверхсжимаемости, но это очень сложные расчеты и без компьютера не обойтись.
в зависимости от pпр и Тпр.находят по графикам. Естъ аналитические методы определения коэффициента сверхсжимаемости, но это очень сложные расчеты и без компьютера не обойтись.
1.6. Влагосодержание газа W - абсолютная, в г/м³; и относительная, доли единицы. Относительная W - отношение фактического количества паров воды в единице объема при определенных Р и Т° к его влагоемкости, т.е. при полном насыщении при этих Р и Т°.
Для расчета  А - влагосодержание идеального газа; β – коэффициент зависящий от состава газа; Р - заданное давление кг/см². А и β в таблице 3.
А - влагосодержание идеального газа; β – коэффициент зависящий от состава газа; Р - заданное давление кг/см². А и β в таблице 3.
Таблица 3 Значение коэффициентов А и В в уравнении влагосодержания газа
| t, ºС | А | В | t, ºС | А | В | t, ºС | А | В |
| -40 -38 -36 -34 -32 -30 -28 -26 -24 -22 -20 -18 -16 -14 -12 -10 -8 -6 -4 -2 | 0,1451 0,1780 0,2189 0,2670 0,3235 0,3930 0,4715 0,5660 0,6775 0,8090 0,9600 1,1440 1,350 1,590 1,868 2,188 2,550 2,990 3,480 4,030 4,670 5,400 6,225 7,150 | 0,00347 0,00402 0,00465 0,00538 0,00623 0,00710 0,00806 0,00921 0,01043 0,01168 0,01340 0,01510 0,01705 0,01927 0,021155 0,02290 0,0271 0,03035 0,03380 0,0377 0,0418 0,0464 0,0515 0,0571 | 8,200 9,390 10,72 12,39 13,94 15,75 17,87 20,15 22,80 25,50 28,70 32,30 36,10 40,50 45,20 50,80 56,25 62,70 69,25 76,70 85,29 94,99 103,00 114,00 | 0,0630 0,0696 0,0767 0,0855 0,0930 0,1020 0,1120 0,1227 0,1343 0,1453 0,1595 0,1740 0,1895 0,207 0,224 0,242 0,263 0,285 0,310 0,335 0,363 0,391 0,422 0,454 | НО | 126,00 138,0 152,0 166,5 183,3 200,5 219,0 238,5 260,0 306,0 335,0 363,0 394,0 427,0 462,0 501,0 537,5 582,5 624,0 672,0 725,0 776,0 1093,0 | 0,487 0,521 0,562 0,599 0,645 0,691 0,741 0,793 0,841 0,902 0,965 1,023 1,083 1,148 1,205 1,250 1,290 1,327 1,327 1,405 1,445 1,487 1,530 2,620 |
Таблица 4 Упругость паров в зависимости от температуры
| t, ºС | pв.п, 0,1 мПа | t, ºС | pв.п, 0,1 мПа | t, ºС | pв.п, 0,1 мПа |
| -40 -35 -30 -25 -20 -15 -10 -5 | 0,00013 0,60023 0,00038 0,00064 0,00105 0,00168 0,00265 0,00490 0,00620 0,00890 | 0,0125 0,0174 0,0238 0,0323 0,0435 0,0573 0,0752 0,0977 0,1258 0,1605 | 0,2031 0,2550 0,3178 0,3931 0,4829 0,5894 0,7149 0,8619 1,0332 1,4609 |
1.7. Теплоемкость газа - отношение теплоты, подведенной к нему, к соответствующему изменению температуры газа. Если к единице количества газа, то это удельная (массовая или молярная) теплоемкость - Дж/кг·С° или ккал/кг·С° (кал./г·С°), 1кал./г·С°=4,1868 Дж/кг·С° или Дж/моль·С°, ккал/моль·С°. Изобарная теплоемкость (при P=const).
1.8. Гидратообразование - природный газ в соединении с водой при определенных условиях образует гидраты - твердые кристаллические вещества. Это не химические, а физические соединения, т.е. молекулы воды входят в межмолекулярное пространство газа. Гидраты очень осложняют процесс исследования и эксплуатации скважин, с ними приходится бороться. Несколько методов определения условий гидратообразований:
1) Экспериментальный - с помощью малогабаритного оборудования в лабораторных и промысловых условиях. Основной узел установки - камера высокого давления (до 25,0 мПа и Т=-30 +50 С°), объем ее 40- 80см³.
2) В поисковом и разведочном процессе приходится пользоваться приближенными аналитическими зависимостями на основе экспериментальных данных. Из них следует:  , где а и b коэффициенты, оцениваемые экспериментально для каждого месторождения (а =12,25-19,9; b=-3,3-(-28,5)). Для Р больше 9,0 мПа, Т гидратообразования приближенно можно оценить:
, где а и b коэффициенты, оцениваемые экспериментально для каждого месторождения (а =12,25-19,9; b=-3,3-(-28,5)). Для Р больше 9,0 мПа, Т гидратообразования приближенно можно оценить:
при положительных температурах:  ,
,  ;
;
при отрицательных температурах:  ,
,  , где β и β1, в рис. 3 в зависимости от отношения суммы парциальных плотностей изучаемого газа
, где β и β1, в рис. 3 в зависимости от отношения суммы парциальных плотностей изучаемого газа  к сумме их объемных (в долях единиц) концентраций в газе. Надо знать состав газа (табл. 2).
к сумме их объемных (в долях единиц) концентраций в газе. Надо знать состав газа (табл. 2).

Рисунок 3. Значения коэффициентов В и В1
Пример. Определить Pгидр при Т=10ºС. Состав газа в таблице 5.

Из графика (рис. 3) находим β=19, тогда lgPp=0,054(10+19)=1,57, Pp=3,71 мПа.
Таблица 5 Результаты расчетов по определению давления гидратообразования
| Компонент | Молекулярная концентрация в газе, % | xiг | piг | xiг· piг |
| C1 | 0,900 | 0,554 | 0,499 | |
| C2 | 0,020 | 1,049 | 0,0621 | |
| C3 | 0,810 | 1,561 | 0,615 | |
| iC4 | 0,5 | 0,005 | 2,864 | 0,010 |
| C4 | 0,5 | 0,005 | - | - |
| iC5 | 0,5 | - | - | - |
| C5 | 0,5 | - | - | - |
| C6+В | 0,4 | - | - | - |
| N2 | 4,6 | - | - | - |
| Сумма: | 0,94 | - | 0,545 |
Пример. Pгд.=5,0 мПа. Состав газа в таблице 5. Какова Тгидр.? ε =0,58 β=19. Тогда  Сº. СО2 и H2S ускоряют процесс гидрообразования.
Сº. СО2 и H2S ускоряют процесс гидрообразования.
3) Графический метод равновесной T и P по отдельным компонентам (рис. 4).

Рисунок 4. Зависимость равновесных параметров гидратообразования природных газов от их плотности
Условия гидратообразования по константам равновесия определяют, используя константы фазового равновесия газ-гидрат, выражаемые формулой  , где yi - молярная доля i-ro компонента природного газа в газовой фазе; xi - молярная доля i-ro компонента газа в гидрате. При известных для заданного условия значениях констант фазового равновесия Ki и составе газа, молярную долю компонентов можно вычислять из выражения
, где yi - молярная доля i-ro компонента природного газа в газовой фазе; xi - молярная доля i-ro компонента газа в гидрате. При известных для заданного условия значениях констант фазового равновесия Ki и составе газа, молярную долю компонентов можно вычислять из выражения  .
.
Если 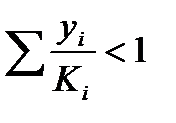 , то при данных условиях гидраты не образуются.
, то при данных условиях гидраты не образуются.
Равновесные условия образования гидратов выражаются равенством:
 .
.
Константы фазового равновесия газ-гидрат зависят от давления, температуры и состава газа. Константы равновесия при положительных температурах определяются по графикам, приведенным на рис. 5 при отрицательных температурах — на рис. 6.

Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах


Продолжение. Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах

Продолжение. Рисунок 5. Константы равновесия газ-гидрата компонентов природного газа при положительных температурах
Гидраты: а – метана; б – этана; в–пропана: г – изобутана; д – сероводорода; е – углекислого газа; ж – азота.

Рисунок 6. Константы равновесия газ-гидрат компонентов природного газа при отрицательных температурах



Продолжение. Рисунок 6. Константы равновесия газ-гидрат компонентов природного газа при отрицательных температурах
а – ж – см. обозначения рис. 5.
Порядок определения равновесных условий гидратообразования по константам фазового равновесия заключается в следующем. Для заданных Р и Т выбираются константы равновесия для каждого гидратообразующего компонента. Процентное содержание каждого компонента делится на его константу равновесия.
Полученные результаты суммируются и если найденная сумма больше 100, то при заданных Р и Т гидраты не могут образоваться, а если полученная сумма меньше 100, гидраты могут образоваться. Если полученная сумма равна 100, то имеет место равновесное условие гидратообразования. Незначительное изменение Р и Т может привести к гидратообразованию.
Пример. Определить условия гидратообразования газа заданного состава при Р1=3,52 мПа, t=8 °С, при Р2=4,22 мПа и t=8 °С (табл. 6).
Из таблицы 6видно, что при заданном составе газов, Р1=3,52 мПа и t = 8°с, полученная сумма 94,34 меньше 100, т. е. существует возможность образования гидратов, а при P2=4,22 мПа и t= 8 °С отсутствует возможность гидратообразования. Порядок определения равновесного давления гидратообразования по константам равновесия следующий.
1. Вычисляется разность давлений - Р1 и P2. Р1 - P2 = 4,22-3,52 = 0,7 мПа.
Таблица 6 Результаты расчетов по определению условий гидратообразования
| Состав газа | Содержание компонентов Vi, % | Ki при p=3,52мПа кгс/см² и t=8ºС | 
| Ki при p=4,22 мПа кгс/см² и t=8ºС | 
|
| N2 СО2 СH4 С2H6 С3H8 С4H10 | 2,24 0,11 93,20 3,28 0,38 0,82 | - 0,8170 1,3940 0,2390 0,0343 0,2390 | - 0,14 66,85 13,72 10,20 3,43 | - 0,7150 1,2630 0,1680 0,0278 0,1680 | - 0,15 73,8 19,5 12,6 4,9 |
| ∑94,34 | ∑110,95 |
2. Вычисляется разность: 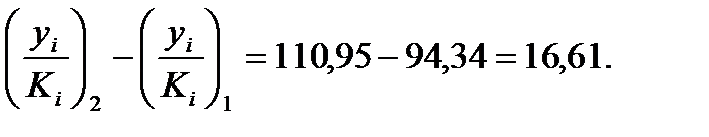
3.Равновесное давление гидратообразования определяется по формуле:
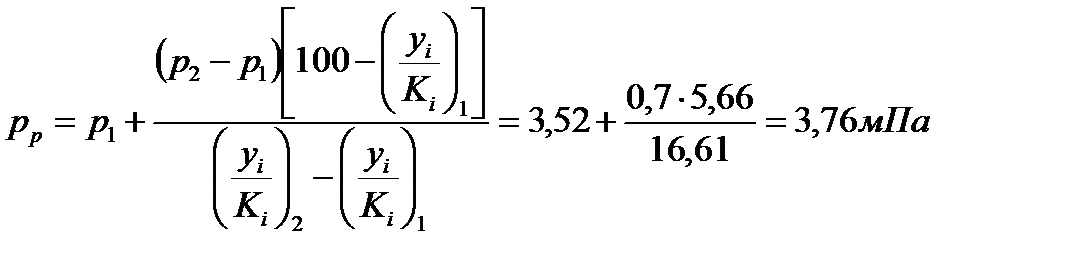
Из приведенного примера видно, что для газа заданного состава и температуры равновесное давление гидратообразования равно 3,76 мПа
1.9. Дросселирование газа - отношение изменения T0 газа в результате его адиабатического расширения к изменению давления называется дроссельным эффектом или эффектом Джоуля-Томсона, (D-T). Адиабатические - это такие процессы, которые происходят в изолированной среде, т.е. без обмена теплотой или работой между системой и окружающей средой. Изменение температуры для снижения давления на 0,1 мПа называется коэффициентом Джоуля-Томсона, он может быть и «+» и «-».
 , где Ср – изобарная теплоемкость, ккал/кг·моль·ºС;
, где Ср – изобарная теплоемкость, ккал/кг·моль·ºС;  - функция по графику 7 в зависимости от Pпр и Тпр , 4,1868 Дж/кг·моль·град., Тпр и Рпр – приведенные температура и давление.
- функция по графику 7 в зависимости от Pпр и Тпр , 4,1868 Дж/кг·моль·град., Тпр и Рпр – приведенные температура и давление.
Пример. Найти коэффициент D-T при снижении Р от 26,0 мПа до 15,0 мПа для газа состава (таблица 5), с начальной Tº=137ºС. Ср для  мПа и Т=137 ºС (по рис.7 для Рпр и Тпр находим
мПа и Т=137 ºС (по рис.7 для Рпр и Тпр находим  =0,35). Получаем Ср=12,76·4,1868 Дж/кг·моль·град, Рпр=205/47,38=4,33, Тпр=410/200=2,05.
=0,35). Получаем Ср=12,76·4,1868 Дж/кг·моль·град, Рпр=205/47,38=4,33, Тпр=410/200=2,05.

Рисунок 7. Обобщенная функция Джоуля-Томсона в зависимости от приведенных температуры и давления
По рис. 7 для Рпр и Тпр находим f(Di)=0,35

Пример. Определить tºС газа после дросселирования от 26,0 до 15,0 мПа с начальной t=120ºС. Состав газа в табл. 7. На рис. 8 проводим линию с начальной точкой t=120 и Р=26,0 мПа параллельно линии графика до Р=15,0 мПа и находим Т=102. По формуле:


Рисунок 8. Номограмма для определения интегрального дроссель-эффекта метана
Таблица 7 Пример расчета теплоемкости природного газа
| Состав газа | xi, об. % | 
| Мi | gi | 
| Мi xi | pкрi | pкрi·xi | Ткрi | Ткрi·xi | ωi | ωi xi |
| СH4 С2H6 С3H8 С4H10 С6H12 СО2 H2S | 93,70 3,04 1,05 0,71 0,17 0,72 0,61 | 9,5 15,0 24,0 30,0 38,0 9,5 7,0 | 16,042 30,066 44,094 58,120 72,151 44,011 28,016 | 0,8620 0,0524 0,0265 0,0236 0,0070 0,0181 0,0097 | 8,189 0,786 0,636 0,708 0,266 0,172 0,068 | 15,03 0,914 0,463 0,413 0,123 0,317 0,171 | 46,95 49,76 43,33 36,71 34,48 76,27 91,35 | 43,99 1,51 0,45 0,27 0,06 0,54 0,56 | 190,5 305,4 369,8 425,6 469,6 304,2 373,6 | 178,54 9,28 3,88 3,02 0,80 2,19 2,28 | 0,0104 0,0986 0,1524 0,2010 0,2539 0,2310 0,1000 | 0,0097 0,0029 0,0016 0,0014 0,0004 0,0016 0,0006 |
 ; М=17,431; pпр.кр=47,38; Тпр.кр=200,0; ω=0,0182.
; М=17,431; pпр.кр=47,38; Тпр.кр=200,0; ω=0,0182.
Дата публикования: 2014-11-02; Прочитано: 3732 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
