 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Способы задания состава смеси. Соотношения между ними
|
|
Газовая смесь может быть задана массовыми, объёмными и мольными долями.
Газовая смесь, заданная массовым составом, характеризуется массовыми долями. Массовой долей компонента gi наз. отношение массы отдельного компонента mi, входящего в смесь, к массе всей смеси Мсм, т.е.
 , (2.22)
, (2.22)
Очевидно, что масса газовой смеси равна сумме масс всех входящих в неё газов:
 (2.23)
(2.23)
Определим сумму массовых долей отдельных газов:
 , (2.24)
, (2.24)
Массовые доли часто задаются в процентах (%).
Газовая смесь, заданная объёмным составом, характеризуется объемными долями (ri). Объёмная доля каждого газа выражается отношением приведенного объёма газа Vi к полному объёму смеси Vсм.
 , (2.25)
, (2.25)
Приведенным Vi наз. объём, который занимал бы компонент газа, если бы его давление рi и температура Тi равнялись давлению рсм и температуре Тсм.
Парциальный объём каждого газа определяется по закону Бойля-Мариотта. При T=const.=Tсм
 , (2.26)
, (2.26)
Из уравнений (2.26) имеем:  ;
;  ; …
; …  , (2.27)
, (2.27)
Сложив отдельно левые и правые части уравнений (2.27), получим:
 , (2.28)
, (2.28)
По закону Дальтона  , следовательно
, следовательно
 , (2.29) То есть сумма парциальных объёмов газа,
, (2.29) То есть сумма парциальных объёмов газа,
составляющих смесь, равна объёму смеси газов (закон Амала).
Сумма объёмных долей газов, составляющих смесь, равна единице
 , (2.30)
, (2.30)
Объёмные доли часто задаются в процентах (%).
Газовая смесь, заданная мольным составом, характеризуется мольными долями. Мольной долей  наз. отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси Ni.
наз. отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси Ni.  , (2.31)
, (2.31)
Вполне очевидно, что сумма молей всех газов, составляющих смесь, равна общему числу молей газовой смеси, т.е.  , (2.32)
, (2.32)
Сумма мольных долей смеси газов равна единице: 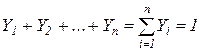 , (2.33)
, (2.33)
Если известен массовый состав смеси, то по нему можно найти её мольный состав. Массы отдельных газов mi и полную массу смеси Мсм можно выразить через число молей следующем образом:  ;
;  ; …
; … 
 , (2.34)
, (2.34)
2.8. Теплоёмкость. Массовая, объёмная и молярная теплоемкости.
Теплоемкости при постоянных объёме и давлении
Теплоёмкостью наз. количество теплоты, необходимое для повышения температуры тела на один градус. Теплоёмкость не является постоянной величиной и в общем случае изменяется с изменением температуры и давления. Теплоёмкость единицы количества вещества наз. удельной теплоёмкостью. Удельная теплоёмкость тела зависит от химического состава, параметров состояния рабочего тела, а также от вида процесса, в котором телу сообщается
теплота, поскольку теплота есть функция процесса. Размерность удельной теплоёмкости:
Дж/(кг(м3, (моль))) К).
В ТТД различают удельные массовую с, (Дж/(кг К)), объемную с', (Дж/(м3 К)) и мольную сµ (Дж/(моль К)) теплоёмкости.
Зависимости между удельными теплоёмкостями устанавливаются из следующих выражений:
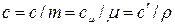 ;
;  , где
, где  , (2.35)
, (2.35)
Различают истинную и среднюю теплоёмкости.
Истинной теплоёмкостьюназ. производная от количества теплоты, подведённой к телу, по температуре этого тела и определяется выражением:
 , (2.36)
, (2.36)
То есть истинная теплоёмкость тела – это его теплоёмкость при данной температуре.
Средней теплоёмкостью наз. теплоёмкость в интервале температур Т2 – Т1, она обозначается Сm. При уменьшении разности температур средняя теплоёмкость приближается к истинной.
 , (2.37)
, (2.37)
Удельной изохорной теплоемкостью  наз. количество теплоты, которое необходимо подвести к рабочему телу в изохорном процессе с тем, чтобы изменить его
наз. количество теплоты, которое необходимо подвести к рабочему телу в изохорном процессе с тем, чтобы изменить его
 температуру на 1 К.
температуру на 1 К.  , (2.38)
, (2.38)
Удельной изобарной теплоемкостью  наз. количество теплоты, которое необходимо подвести к рабочему телу в изобарном процессе с тем, чтобы изменить его температуру на 1 К.
наз. количество теплоты, которое необходимо подвести к рабочему телу в изобарном процессе с тем, чтобы изменить его температуру на 1 К.  , (2.39)
, (2.39)
Дата публикования: 2014-11-04; Прочитано: 6425 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
