 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Практических занятий
|
|
В соответствии с Государственным образовательным стандартом специалисты, выпускники теплоэнергетических специальностей вузов, должны не только понимать физику процессов, происходящих при работе оборудования, в частности, при работе топливоиспользующего оборудования, но и уметь применять теоретические знания при решении практических задач как при конструировании и наладке, так и при эксплуатации его.
Наиболее глубокое понимание любого явления достигается путем аналитического и экспериментального изучения влияния на него различных факторов. Практические занятия по дисциплине «топливо и теория горения» позволяют студентам на конкретных примерах оценить воздействие различных влияющих факторов на экономичность и надежность процессов сжигания различных топлив, на тепловое и температурное состояние горящего факела, продуктов сгорания и поверхностей теплообмена. При решении предлагаемых ниже задач студенты изучают методики и приобретают навыки практических расчетов, необходимых в дальнейшей инженерной деятельности.
При решении задач рекомендуется следующая точность расчетов: величины, имеющие большее численное значение (энтальпия, температура, объемы), ограничиваются одним знаком после запятой; удельные объемы − двумя знаками после запятой; величины, имеющие малые численные значения (доли трехатомных газов, избытки воздуха и др.), − тремя знаками после запятой.
Задача 1
Элементарный состав горючей массы кузнецкого угля марки СС: НГ =3,3 %; СГ =80,2 %; NГ =2,1 %; ОГ =14 %; SГ =0,4 %. Зольность на сухую массу АС =22,12 %. Определить элементарный состав топлива на рабочую массу, если W Р=15,0 %.
Порядок решения. Коэффициент пересчета масс имеет вид К =0,01(100- WP - AP)/100. Пересчет зольности с сухой массы на рабочую АР =0,01 АС (100- WР). Определяем элементарный состав на рабочую массу: СР = СГ × К; ОР = ОГ × К; НР = НГ × К; NP = NГ × К; SP = SГ × К. Полный элементарный состав рабочей массы:
СР + НР + ОР + NP + SP + AP + WP должен быть равен 100 %.
Задача 2
У Кузнецкого угля (элементарный состав − см. задачу 1) низшая теплота сгорания QPH =23990 КДж/кг. Определить QCH, QГН, QР В.
Порядок решения
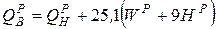 ;
;
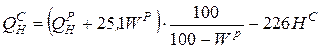 ;
;
 .
.
Задача 3
Назаровский уголь имеет влажность WP =39 %, теплоту сгорания QРН =13020 кДж/кг. При сжигании угольной пыли этого угля по схеме замкнутой сушки вся влага рабочего состава топлива подается с пылью в топку. При переходе на сжигание по схеме разомкнутой сушки в топку подается пыль с влажностью Wпл = 10,0 %. Насколько увеличится низшая теплота сгорания?
Порядок решения
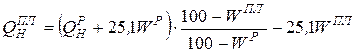 .
.
Задача 4
В топке сжигается смесь топлив: GТ =25 т/ч твердого топлива с  =20934 кДж/кг и VГ =15×103 м3/ч газа с теплотой сгорания
=20934 кДж/кг и VГ =15×103 м3/ч газа с теплотой сгорания  =36×103 кДж/м3. Определить условную теплоту сгорания смеси топлив.
=36×103 кДж/м3. Определить условную теплоту сгорания смеси топлив.
Порядок решения
При сжигании твердого или жидкого топлива в смеси с газообразным, расчет ведется по условной теплоте сгорания, отнесенной к 1 кг твердого или жидкого топлива,
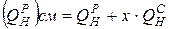 ,
,
где 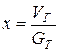 .
.
Задача 5
Определить теоретически необходимое количество воздуха при сжигании смеси твердого и газообразного топлива (ирша-бородинского угля марки Б2 и Бухарского природного газа) с теплотами сгорания соответственно QPH=15670 кДж/кг и QСН=36720 кДж/м3. Доля природного газа в общем тепловыделении q²=0,4.
Порядок решения
Для смеси твердого (или жидкого) топлива с газообразным теоретически необходимое для горения объемное количество воздуха определяются соотношением
 ,
,
количество газа, приходящееся на 1 кг твердого топлива,
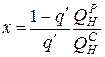 ,
,
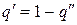 .
.
Задача 6
Определить размеры коробов уходящих газов установки, сжигающей сернистый мазут. Расход мазута Вм=8,3 кг/с, температура уходящих газов uуг=150 °С при избытке воздуха aуг=1,18. Принять скорость уходящих газов wг = 10 м/с, соотношение сторон газохода 1:4, количество коробов 2.
Порядок решения
1. Определяется объем продуктов сгорания на 1 кг топлива, м3/кг:
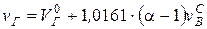 .
.
2. Секундный расход уходящих газов при нормальных условиях, м3/с:
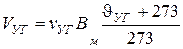 .
.
3. Необходимое сечение одного газохода, м2:
 .
.
4. Линейные размеры газохода в:h, м:
так как в =4 h, то FГ = вh =4 h 2, 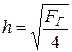 .
.
Задача 7
Определить энтальпии продуктов сгорания в точках газового тракта:
1) u = 1700 °С, a = 1,1; 2) u = 850 °С, a = 1,16 при подаче в эти точки газов рециркуляции uр = 390 °С, aР = 1,2, доля рециркуляции rр = 0,15. Топливо − мазут сернистый.
Порядок решения
1. Энтальпия газов при a>1 определяется из выражения
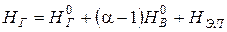 ;
;
вычисляем энтальпию газов для точек 1), 2) и энтальпию газов рециркуляции.
2. Энтальпии газов в точках 1) и 2) после смешения с газами рециркуляции определяем из выражения
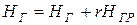 ,
,
где НГ и НГР − энтальпии газов основного потока и рециркулируемых газов.
Задача 8
Рассчитать скорость витания угольной частицы размерами а´в´с®1´0,4´0,3 мм в потоке дымовых газов, имеющих температуру ТГ=1400 К, плотность при нормальных условиях rГО=1,293 кг/м3, коэффициент кинематической вязкости nг=220×10-6 м2/с. Плотность частицы rЧ=1250 кг/м3.
Порядок решения
1. Плотность газового потока, кг/м3
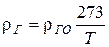 .
.
2. Диаметр шара, аэродинамически подобного частице, мм
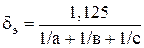 .
.
3. Критерий Кирпичева
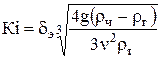 ,
,
где dэ − в метрах.
4. Критерий Шиллера (с погрешностью до 10 %)
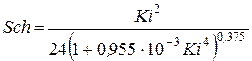 .
.
4а. Критерий Шиллера (с погрешностью до 25 %)
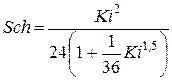
5. Скорость витания из выражения (с погрешностью 10 % и 25 %)
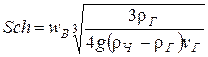 ,
,
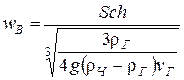 .
.
Задача 9
Частица угольной пыли размерами а´в´с®0,9´0,35´0,3 мм движется в вертикальной трубе-сушилке высотой L = 10 м, подхваченная потоком сушильного агента, имеющего скорость wг=20 м/с, температуру Тг = 1200 К, плотность rг = 1,25 кг/м3, коэффициент кинематической вязкости 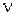 г = 150×10-6 м2/с. Плотность частицы rЧ=1000 кг/м3. Определить время пребывания частицы в трубе.
г = 150×10-6 м2/с. Плотность частицы rЧ=1000 кг/м3. Определить время пребывания частицы в трубе.
Порядок решения
1. Диаметр шара, аэродинамически подобного частице, мм
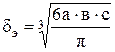 .
.
2. Критерий Кирпичева
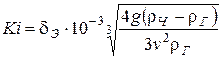 .
.
3. Критерий Шиллера при R£100
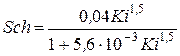 .
.
4. Скорость витания, м/с
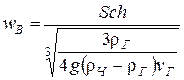 .
.
5. Проверка возможности применения использованной в расчете формулы по п. 3,
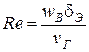 .
.
6. Время пребывания частицы угля в сушилке
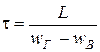 .
.
Задача10
В закрытом сосуде при адиабатных условиях происходит воспламенение и горение газовой смеси с кинетическими характеристиками: Е=105 кДж/кмоль, kО=5×106 с-1. Адиабатическая температура горения Та=2200 К, начальная температура смеси: а) ТО1=350 К, б) ТО2=1000 К.
Определить для а) и б): периоды индукции tИНД1 и tИНД2; температуру воспламенения смеси; температуру в точке максимума тепловыделения; периоды горения tГ1 и tГ2.
Порядок решения
1. Определим безразмерные начальные температуры смеси Q01 и Q02 и критерий Аррениуса Аrr:
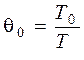 ;
; 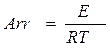 ,
,
где R=8,31×103 Дж/(кмоль×К) − универсальная газовая постоянная.
2. Определим периоды индукции tИНД1 и tИНД2 для условий а) и б)
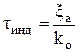 ,
,
где для закрытого сосуда 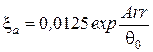
и определим, во сколько раз уменьшится период индукции с ростом начальной температуры смеси от 350 К до 1000 К.
3. Определим температуру воспламенения смеси
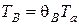 ,
,
где 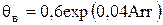 .
.
Эта температура, соответствующая максимуму второй производной температуры по времени, может считаться физико-химической константой смеси, так как при адиабатных условиях горения не зависит ни от начальной температуры смеси, ни от схемы организации процесса.
4. Температура в точке максимума тепловыделения определяется по формуле
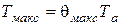 ,
,
где  .
.
Эта температура является максимумом первой производной температуры по времени, как и ТВ, она не зависит от начальной температуры смеси.
5. Периоды горения tГа и tГб определяются из выражения
tг = xг / kо,
где 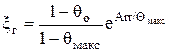 .
.
Анализ решения по п. п. 2 и 5 покажет, что при низких начальных температурах смеси период горения tГ составляет незначительную часть периода индукции tИНД и процесс выгорания топлива в основном зависит от периода индукции.
Задача 11
Рассчитать количество NO2, образующегося при работе котла на мазуте при следующих условиях: адиабатическая температура в ядре факела Та=2237 К; объем топки VТ=1440 м3; коэффициент избытка воздуха на выходе из топки aТ=1,05; расход топлива В=8,5 кг/с; содержание азота в топливе Nр=0,21 %; объем теоретически необходимого воздуха Vо=10,61 м3/кг; объем продуктов сгорания VГ=13,38 м3/кг, объем сухих продуктов сгорания VсухГ=11,56 м3/кг. Котел работает под разрежением.
Порядок решения
1. По теории Семенова - Зельдовича - Франк-Каменецкого образование оксидов азота происходит в результате цепных реакций в присутствии атомарного азота и кислорода:
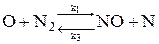 ;
;
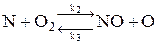 ,
,
где k1; k2; k3; k4 − константы скорости прямых и обратных реакций.
Определяем константу скорости реакции k2 по экспериментальной зависимости, м3/(моль)
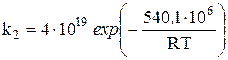 .
.
2. Определяем концентрацию кислорода, кмоль/м3
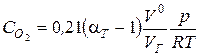 ,
,
где р − давление дымовых газов в топке котла (р = 0,981×105 Па), Т=ТМ - максимальная температура газов в топке, Тм = (0,8…0,87) Та @ 1790 К.
3. Определяем концентрацию азота, кмоль/м3
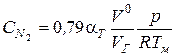 .
.
4. Определяем константу равновесия процесса образования оксидов азота КР: константы равновесия первой и второй ценных реакций равны соответственно
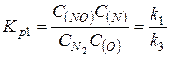 ;
; 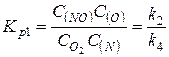 ;
;
константа равновесия процесса в целом
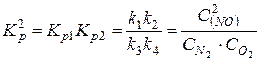 .
.
Скобки у индексов концентраций обозначают значения равновесных концентраций.
С другой стороны, константа равновесия для химически реагирующей смеси идеальных газов имеет вид
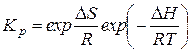 ,
,
где 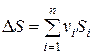 − изменение энтропии реагирующей системы,
− изменение энтропии реагирующей системы, 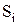 − энтропии исходных веществ и продуктов реакций;
− энтропии исходных веществ и продуктов реакций; 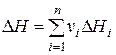 − изменение энтальпии (тепловой эффект реакции, т. е.
− изменение энтальпии (тепловой эффект реакции, т. е. 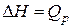 ),
), 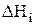 − теплота образования исходных веществ и продуктов реакции;
− теплота образования исходных веществ и продуктов реакции; 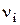 − коэффициенты стехиометрического уравнения реакции (принимаются положительными для продуктов реакции и отрицательными для исходных веществ).
− коэффициенты стехиометрического уравнения реакции (принимаются положительными для продуктов реакции и отрицательными для исходных веществ).
При расчете константы равновесия КР необходимо использовать табличные значения 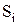 и
и 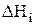 , приводимые в справочниках (например Термодинамические свойства индивидуальных веществ/ Л.В. Гурвич, Г.А. Хачкурузов, В.А. Медведев и др. − М.: Изд-во АН СССР, 1961, Т. 1 и 2). Для рассматриваемой в задаче цепной реакции
, приводимые в справочниках (например Термодинамические свойства индивидуальных веществ/ Л.В. Гурвич, Г.А. Хачкурузов, В.А. Медведев и др. − М.: Изд-во АН СССР, 1961, Т. 1 и 2). Для рассматриваемой в задаче цепной реакции 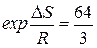 , а
, а 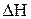 =180×106 Дж/кмоль,
=180×106 Дж/кмоль,
тогда
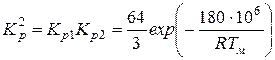 ;
;
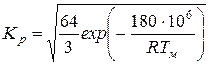 .
.
5. Вычисляем равновесную концентрацию оксида азота
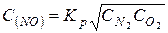 .
.
6. Определяем начальную концентрацию атомарного азота, кмоль/м3
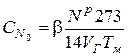 ,
,
где b − поправка на степень конверсии азота топлива, для мазута b=0,5.
7. Определяем время пребывания продуктов сгорания в топке, с
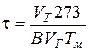 ,
,
где В − расход топлива, кг/с.
8. Определяем безразмерное время реакции образования оксидов азота в топке
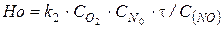 ,
,
и безразмерную концентрацию оксида азота
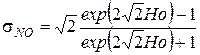 .
.
9. Рассчитываем концентрацию оксида азота
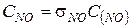 ,
,
и определяем количество генерируемого при заданных условиях работы котла диоксида азота
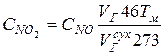 .
.
Задача 12
Как изменится выход NO2 в атмосферу, если коэффициент избытка воздуха на выходе из топки a²Т=1,1? Остальные условия принять из задачи 11.
Примечание: 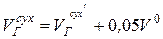 ;
;
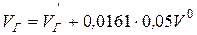 ,
,
где 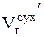 и
и 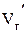 равны соответственно
равны соответственно 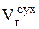 и
и 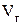 , взятым из задачи 11.
, взятым из задачи 11.
Задача 13
Как изменится выход NO2 в атмосферу, если ТМ станет равным 1690 К? Остальные условия принять из задачи 11.
Задача 14
Определить нормальную скорость распространения пламени, если на цилиндрической горелке диаметром 2×10-2 м получено конусное пламя с высотой конуса 2×10-2 м. В горелку подается водородовоздушная смесь с коэффициентом избытка воздуха a=1,1, а количество подаваемого водорода VН2=3×10-4 м3/с.
Порядок решения
1. Стехиометрическое количество воздуха, подаваемого на сжигание 1 м3 газообразного топлива, м3/м3
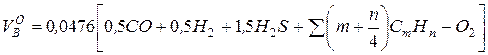 ,
,
а действительное количество воздуха, м3/м3
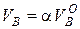 .
.
2. Расход газовоздушной смеси через горелку, м3/с
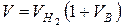 .
.
3. Площадь боковой поверхности конуса, м2
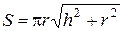 ,
,
где h и r − высота и радиус основания конуса.
4. Нормальная скорость распространения пламени
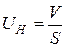 .
.
Задача 15
Определить диаметр ячеек сетки, не пропускающей пламя, для топливо-воздушной смеси, кинетические константы которой: Е = 129,8 кДж/моль; kО=2,14×1014 с-1. Адиабатическая температура горения Та = 2183 К; температура сетки 300 К, коэффициент теплоотдачи a=11,0 Вт/(м2К); ср=1,04 кДж/(кгК);
rО=1,17 кг/м3.
Порядок решения
1. Определим критерий Аррениуса
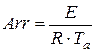
и безразмерную температуру сетки
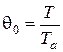 .
.
2. Критическое значение критерия теплоотвода
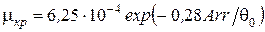 .
.
3. Определим критический диаметр ячеек сетки. Для этого критическое значение критерия теплоотвода приравняем текущему его значению
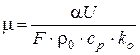 ,
,
где U − периметр ячейки сетки, F − площадь ячейки;
для круглой ячейки
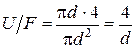 ;
;
для квадратной ячейки
 ,
,
здесь а − длина стороны ячейки;
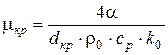 ,
,
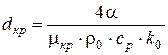 .
.
Дата публикования: 2014-11-04; Прочитано: 1235 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
