 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
В каждой орбитали может разместиться не более двух электронов
|
|
Один электрон на орбитали называется неспаренным, два электрона – электронной парой:

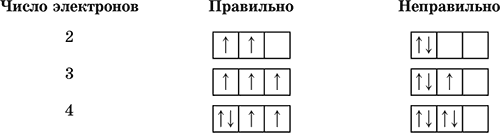
3) принцип максимальной мультиплетности (правило Хунда)
В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
Каждый электрон имеет свою собственную характеристику – спин (условно изображается стрелкой вверх или вниз). Спины электронов складываются как вектора, сумма спинов данного числа электронов на подуровне должна быть максимальной (мультиплетность):
Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Kr (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов):

Из заполненных энергетических диаграмм выводятся электронные формулы атомов элементов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы (например, 3 d 5 – это 5 электронов на З d ‑подуровне); вначале идут электроны 1‑го уровня, затем 2‑го, 3‑го и т. д. Формулы могут быть полными и краткими, последние содержат в скобках символ соответствующего благородного газа, чем передается его формула, и, сверх того, начиная с Zn, заполненный внутренний d‑подуровень. Примеры:
1H = 1s1
2Не = 1s2
3Li = 1s22s1 = [2He]2s1
8O = 1s2 2s22p4 = [2He] 2s22p4
13Al = 1s22s22p6 3s23p1 = [10Ne] 3s23p1
17Cl = 1s22s22p6 3s23p5 = [10Ne] 3s23p5
2OСа = 1s22s22p63s23p 4s2 = [18Ar] 4s2
21Sc = 1s22s22p63s23p6 3d14s2 = [18Ar] 3d14s2
25Mn = 1s22s22p63s23p6 3d54s2 = [18Ar] 3d54s2
26Fe = 1s22s22p63s23p6 3d64s2 = [18Ar] 3d64s2
3OZn = 1s22s22p63s23p63d10 4s2 = [18Ar, 3d10] 4s2
33As = 1s22s22p63s23p63d10 4s24p3 = [18Ar, 3d10] 4s24p3
36Kr = 1s22s22p63s23p63d10 4s24p6 = [18Ar, 3d10] 4s24p6
Электроны, вынесенные за скобки, называются валентными. Именно они принимают участие в образовании химических связей.
Исключение составляют:
24Cr = 1s22s22p63s23p6 3d54s1 = [18Аr] Зd54s1 (а не 3d44s2!),
29Cu = 1s22s22p63s23p6 3d104s1 = [18Ar] 3d104s1 (а не 3d94s2!).
Дата публикования: 2014-11-04; Прочитано: 2129 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
