 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Механизм образования ДЭС
|
|
ДЭС возникает вследствие пространственного разделения зарядов, которое может возникнуть разными путями.
1. Поверхностная ионизация (переход ионов или электронов из одной фазы в другую).
Переход ионов осуществляется до тех пор, пока не наступит равновесие электрохимических потенциалов ионов в обеих фазах.
При погружении металла в раствор его соли в зависимости от концентрации раствора одинаково вероятен как переход ионов металла из кристаллической решетки металла в раствор, так и обратный процесс. И в том и в другом случае на электроде создастся либо избыток, либо недостаток электронов. В связи с этим к электроду притягиваются те или иные ионы. Так на границе электрода с раствором образуются два слоя противоположных зарядов: один на самом электроде, другой в растворе, в непосредственной близости от электрода.
Заряд на электроде может возникать и за счет внешнего источника тока. Тогда на одном электроде образуется избыток отрицательных зарядов, и около него сосредотачиваются катионы раствора, а на другом электроде - избыток положительных зарядов, и около него сосредотачиваются анионы. В любом случае на границе между электродом и раствором всегда образуется двойной электрический слой.
Ме Меn+
2. Ионизация молекул вещества твердой фазы - диссоциация поверхностных функциональных групп, например, поликремниевых кислот, образующихся за счет поверхностной гидратации при контакте с водой SiO2:
SiO2 + Н2О= Н2SiO3 = Н+ + НSiO3- (тв. частица «-», среда «+»).
3. Адсорбция ионов
А) не входящих в кристаллическую решетку:
органические ионы,
ионы с большой адсорбционной способностью: Н+, ОН-, Cl-.
Катионы и анионы в силу различия их поляризуемости, гидратируемости и т.д. адсорбируются по-разному. Преимущественная адсорбция одного из ионов на твердой поверхности приводит к образованию ДЭС.
Например, в системе металл - водный раствор NaCl, ионы Cl- адсорбируются сильнее, чем ионы Na+ (при одинаковом заряде ион Cl- имеет больший радиус). В результате, поверхность металла заряжается отрицательно, а прилегающий к ней слой воды - положительно.
Особо сильной адсорбционной способностью из водных растворов обладают органические ионы. Так, в лабораторном практикуме часто применяются полистирольные латексы - дисперсии частиц полистирола в воде, получаемые полимеризацией стирола в присутствии ПАВ. Стабилизирующий систему двойной электрический слой на поверхности частиц латекса образуется в результате адсорбции молекул ионогенных ПАВ, например, олеата натрия C17H35COONa.
Поверхность кристаллов AgJ, погруженных в воду, приобретает отрицательный заряд, а прилегающий слой воды - положительный, в результате преимущественного перехода в воду ионов Ag+ (они сильнее гидратируются, чем ионы Cl-).
Б) избирательная адсорбция ионов по правилу Панета-Фаянса.
При погружении кристаллов AgJ в водный раствор солей серебра, например, AgNO3 происходит достройка кристаллической решетки AgJ ионами Ag+ из раствора. В результате чего твердая поверхность заряжается положительно, а прилегающий слой воды за счет избытка там ионов NO3- - отрицательно.
Ионы, способные таким образом достраивать кристаллическую решетку солей или металлов, называют неиндифферентными (потенциалопределяющими). Согласно правилу Панета-Фаянса, достраивать кристаллическую решетку могут следующие ионы:
а) ионы, входящие в состав кристаллической решетки (как в описанном случае),
б) ионы, образующие с одним из ионов кристаллической решетки трудно растворимые соли. Так, в рассмотренном случае достраивать решетку AgJ могли бы и ионы Cl-, Br-, CNS- и др.
4. Поляризация поверхности за счёт внешнего электрического поля.
Так происходит поляризация ртутного электрода, погруженного в раствор – электролит.
Строение ДЭС
Современная теория строения ДЭС (развитая в работах Гуи(*), Чапмена(*), Штерна(*), Фрумкина(*), Грэма(*), Гельмгольца(*)) основана на анализе электростатического взаимодействия ионов в ДЭС в сопоставлении с межмолекулярном взаимодействием и тепловым движением ионов.
Согласно этой теории, на поверхности частиц дисперсной фазы возникает заряд вследствие адсорбции потенциалопределяющих ионов или поверхностной ионизации.
В случае адсорбции потенциалобразующих ионов (правило Панета – Фаянса) величина и знак полного термодинамического потенциала φо на поверхности частиц дисперсной фазы зависит от количества и знака адсорбированных ионов. Этот потенциал притягивает противоположно заряженные ионы в растворе.
Одна часть противоионов примыкает непосредственно к заряженной поверхности, образуя плотный (адсорбционный) слой – слой Гельмгольца, толщина плотного слоя d принимается равной радиусу гидратированного противоиона. Эту часть ДЭС можно рассматривать как плоский конденсатор, в котором потенциал, как известно, снижается линейно.
 (5.1)
(5.1)
Другая часть противоионов под действием теплового движения распространяется вглубь фазы, образуя так называемый диффузный слой, или слой Гуи.
Образовавшийся плоский конденсатор необычен. Расстояние между его "обкладками" равно радиусу ионов, то есть стомиллионным долям сантиметра. Если разность потенциалов равна одному вольту, то напряженность электрического тока достигает при этом миллиона вольт на сантиметр. Это очень высокая напряженность. Даже в мощных электростатических ускорителях заряженных частиц она гораздо меньше. Естественно предположить, что при такой высокой напряженности электрического поля реакционная способность веществ меняется, изменяются вообще химические свойства вещества. На катоде такие поля способны извлечь электроны из металлов и вызвать нейтрализацию катионов. А на аноде они обусловливают начальный акт растворения - переход металла из кристаллической решетки в двойной слой в виде ионов.
В диффузном слое противоионы распределены неравномерно, поэтому потенциал в диффузной части слоя снижается с расстоянием по экспоненте.
j = jd×e-×Х/d (5.2)
где jd - потенциал на границе адсорбционного и диффузного слоев; x - расстояние от начала диффузной части ДЭС в глубину жидкой фазы; δ - толщина диффузной части слоя.
За толщину диффузной части слоя δ принимают расстояние, на котором jd уменьшается в е раз (jd/е). Из теории Штерна оно равно:
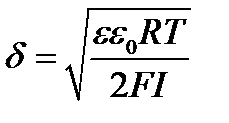
(5.3)
I = ½ SCi×zi2
e - относительная диэлектрическая проницаемость среды, F - постоянная Фарадея, I - ионная сила раствора, Ci- концентрация i – го иона в растворе, zi - заряд иона.
Из уравнения (5.3) следует, что δ уменьшается с ростом концентрации электролита, заряда его ионов и с понижением температуры.
Экспериментальных методов измерения j0 не существует.
За толщину диффузной части δ слоя принято расстояние, на котором φ оуменьшается в е раз.
Толщина диффузной части уменьшается при увеличении концентрации ионов электролита (c io), заряда его ионов (z i) и с понижением температуры (Т): 
 (k – коэффициент пропорциональности, включающий диэлектрические постоянные среды и вакуума, универсальную газовую постоянную R и число Фарадея F). Значения δ для сильно разбавленных растворов электролитов составляют десятки нанометров, т.е. намного превосходят размеры молекул и ионов в растворе.
(k – коэффициент пропорциональности, включающий диэлектрические постоянные среды и вакуума, универсальную газовую постоянную R и число Фарадея F). Значения δ для сильно разбавленных растворов электролитов составляют десятки нанометров, т.е. намного превосходят размеры молекул и ионов в растворе.
Суммарный заряд противоионов адсорбционного слоя не полностью компенсирует заряд поверхности частицы, и на границе раздела адсорбционного и диффузного слоев существует заряд, обуславливающий существование потенциала Штерна (φ d- потенциала).
Строение диффузной части ДЭС определяется соотношением потенциальной энергии притяжения противоионов к заряженной поверхности и кинетической энергии их теплового движения.
Схематическое распределение потенциала в ДЭС см. на рис.5.2:
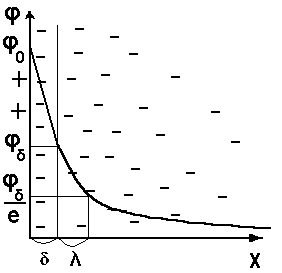
Рис.5.2. Схема распределение потенциала в ДЭС
При относительном перемещении фаз происходит разрыв двойного электрического слоя по плоскости скольжения. Разрыв ДЭС может произойти даже вследствие броуновского движения частиц дисперсной фазы. Плоскость скольжения обычно проходит по диффузному слою, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и дисперсная фаза оказываются противоположно заряженными.
Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называют электрокинетическим потенциалом или ζ(дзета)-потенциалом.
В общем случае ζ -потенциал всегда меньше φ d– потенциала, но для упрощения обычно принимают, что плоскость скольжения делит адсорбционную и диффузную части ДЭС и ζ = φ d.
Значение электрокинетического потенциала определяют, изучая электрокинетические явления (обычно электроосмос и электрофорез). Дзета- потенциал, возникающий при электроосмосе или электрофорезе, рассчитывают по уравнению Гельмгольца – Смолуховского

 (5.4)
(5.4)
или
 , (5.5)
, (5.5)
где η – вязкость среды; U o– линейная скорость движения фаз; Е – напряженность электрического поля; U эф – электрофоретическая подвижность, она равна:
 . (5.6)
. (5.6)
Здесь L – расстояние между электродами: V – разность потенциалов: а – сдвиг границы золь – контактная жидкость за время t.
ζ-потенциал – важнейшая характеристика, поскольку определяет скорость перемещения частиц дисперсной фазы и дисперсионной среды и устойчивость золей.
Строение ДЭС можно записать в виде формулы мицеллы золя. Мицелла – электрически нейтральная коллоидная частица.
Например, получение золя иодида серебра:
AgNO3 + KJ = AgJ + KNO3
 производят в избытке либо AgNO3, либо KJ.
производят в избытке либо AgNO3, либо KJ.
Рис.5.3. Двойной электрический слой мицеллы AgJ, полученной при избытке KJ.
Стабилизатором частиц в этом случае выступает ДЭС, образованный неиндифферентными ионами Ag+ или J- и противоионами K+ или NO3- Например, при избытке в растворе ионов иода последние являются неиндифферентными и потенциалопределяющими. Адсорбируясь на поверхности кристалла AgJ, они достраивают кристаллическую решётку и заряжают поверхность своим знаком заряда. В роли противоионов выступают ионы калия, часть которых будет находиться в адсорбционном слое, а другая часть - в диффузном слое.
Для такой системы формулу ДЭС записывают следующим образом:
 , где m>>n
, где m>>n
|← ядро |
|←коллоидная частица с зарядом (-х)|
|← мицелла (электронейтральна) →|
Коллоидную частицу вместе с двойным электрическим слоем называют мицеллой. Внутреннюю часть мицеллы составляет агрегат - микрокристалл AgJ, состоящий из m пар ионов Ag+ и J-. Агрегат вместе с n потенциалопределяющих ионов (здесь J-) составляет ядро мицеллы. Ядро мицеллы и (n-x) противоионов плотной (адсорбционной) части ДЭС образуют гранулу или частицу. Гранулу окружают x противоионoв диффузного слоя.
Если же указанная система получена при избытке нитрата серебра, то неиндифферентными и потенциалопределяющими являются ионы Ag+, и формула мицеллы (строение двойного электрического слоя) имеет вид:
{m[AgJ] nAg+ (n-x)NO3-}x+ xNO3-
Мицелла гидрофобного золя BaSO4, стабилизированного BaCl2:
{m [BaSO4] n Ba2+ 2(n-х)Cl-} 2х Cl-
5.4. Факторы, влияющие на величину ζ -потенциала:
В общем случае z - потенциал всегда меньше jd потенциала - на границе адсорбционного и диффузного слоев, но для упрощения обычно принимают, что плоскость скольжения проходит именно по границе адсорбционной и диффузной частей ДЭС и z = jd. Таким образом, все факторы, влияющие на jd и толщину d диффузного слоя, изменяют и z - потенциал. Так, согласно уравнениям (5.1) и (5.2), понижение температуры, введение в систему индифферентного электролита (ионы, которого не способны достраивать кристаллическую решетку) и увеличение заряда его ионов ведут к уменьшению толщины диффузного слоя, снижению jd и - электрокинетического потенциала. Рассмотрим подробнее влияние этих факторов.
1. Влияние индифферентных электролитов (не изменяющих φо-потенциал), не содержащих ионы, входящие в состав решетки твердой фазы:
А) в состав входят ионы, сходные с противоионами исходного ДЭС
↑Со =→ ↓δ (сжатие) =→ ↓ ζ -потенциал (кривая 1)
Влияние концентрации такого электролита на величину z - потенциала иллюстрирует рис.5.4.

Рис.5.4. Влияние концентрации - С индифферентного электролита на z - потенциал мицелл.
Увеличение концентрации от C1 до C3 уменьшает толщину диффузного слоя (ионы из него переходят в адсорбционный слой) от l1 до l3 и - значение z- потенциала от z1 до z3. При C4 двойной электрический слой состоит лишь из слоя Гельмгольца и z- потенциал равен нулю. Такое состояние коллоидной системы называют изоэлектрическим, а формула ДЭС мицеллы (5.3) в этом случае имеет вид:
{m[AgJ] nJ- nK+}0
Коллоидные системы, находящиеся в изоэлектрическом состоянии, не участвуют в электрокинетических явлениях.
Б) Влияние электролитов, не имеющих общих ионов с противоионами ДЭС мицелл.
Закономерности влияния концентрации таких электролитов на z- потенциал мицелл аналогичны рассмотренным: с увеличением С электрокинетический потенциал уменьшается вплоть до нуля (изоэлектрического состояния).

Рис.5.5. Влияние концентрации электролитов на z - потенциал: 1 – KCl, 2 – CaCl2, 3 –FeCl3, 4 – ThCl4
При этом ионы добавленного электролита могут вытеснять противоионы адсорбционного слоя ДЭС, замещая их (обменная адсорбция). Особенно свойственно данное явление индифферентным многовалентным ионам, таким как Al+3, Th+4, (РО4)-3, а также - органическим ионам. Они при одинаковой концентрации снижают z- потенциал значительно сильнее, чем рассмотренные выше однозарядные противоионы K+ или NO3- (рис.5.5).
 Это объясняется тем, что многозарядные ионы обладают большей адсорбционной способностью, сильнее притягиваются заряженным ядром мицеллы. Войдя в адсорбционный слой ДЭС, они компенсируют сразу несколько зарядов поверхности, вызывая изоэлектрическое состояние при существенно меньших концентрациях, чем одновалентные ионы. Они способны не только полностью скомпенсировать заряд ядра, но и перезарядить коллоидные частицы (рис. 5.6).
Это объясняется тем, что многозарядные ионы обладают большей адсорбционной способностью, сильнее притягиваются заряженным ядром мицеллы. Войдя в адсорбционный слой ДЭС, они компенсируют сразу несколько зарядов поверхности, вызывая изоэлектрическое состояние при существенно меньших концентрациях, чем одновалентные ионы. Они способны не только полностью скомпенсировать заряд ядра, но и перезарядить коллоидные частицы (рис. 5.6).
Рис.5.6. Падение потенциала в пределах двойного электрического слоя при перезарядке частицы мицеллы
Ионы одинаковой валентности снижают электрокинетический потенциал в соответствии с их радиусом. Так, известны следующие ряды понижающего действия концентрации ионов на z - потенциал:
Li+< Na+< K+< Rb+
Mg+2< Ca+2< Sr+2< Ba+2
Ионы с малым радиусом слабее поляризуются, сильнее гидратируются и поэтому труднее входят в адсорбционную часть ДЭС (для этого им нужно сбросить часть «гидратной шубы», а этот процесс энергетически не выгоден) и в меньшей степени снижают z - потенциал.
2. Влияние неиндифферентных электролитов (способных изменять φо-потенциал), содержащих ионы, которые могут входить в состав решетки твердого тела):
А) ион, способный входить в состав решетки твердого тела имеет тот же знак, что и φо-потенциал
.

Рис.5.7. Зависимость электрокинетического потенциала от концентрации неиндифферентных ионов
Например, потенциалопределяющими ионами мицеллы {m[AgJ]nAg+(n-x)NO3-}+xNO3- служат неиндифферентные ионы Ag+, и мы добавляем в систему раствор-электролит AgNO3.
При малых концентрациях электролита с увеличением концентрации С электрокинетический потенциал растет за счёт повышения потенциала поверхности j0 при адсорбции на ней неиндифферентных ионов.
При повышенных концентрациях электролита преобладающим становится влияние ионов NO3-, введенных вместе с неиндифферентными - противоионами ДЭС. Они сжимают диффузный слой, вызывая снижение z - потенциала. По этой причине в данном случае зависимость электрокинетического потенциала мицелл от концентрации неиндифферентных ионов имеет экстремум (рис. 5.7).
Б) Влияние электролита, содержащего неиндифферентные ионы противоположные по знаку потенциалопределяющим ионам мицеллы.
Например, к системе мицелл {m[AgJ]nAg+(n-x)NO3-}+хxNO3- прибавляют электролит KJ, содержащий неиндифферентные ионы J-, противоположные по знаку потенциалопределяющим ионам Ag+.
В этом случае адсорбция ионов йода на поверхности агрегата приведёт к снижению j0 потенциала поверхности и тем самым – к снижению и z - потенциала. Это видно из рис. 5.8. На нём увеличение концентрации электролита от С1 до С3 приводит к снижению j0 потенциала от j01 до j03, а z-потенциала – от z1 до z3.
В предельном случае при С4 возможна перезарядка коллоидной частицы - z4 при j04.
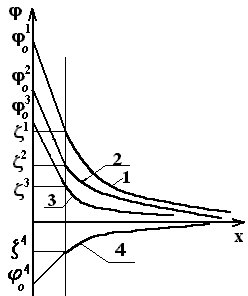
Рис. 5.8. Падение потенциала в пределах ДЭС мицелл при различных концентрациях неиндифферентных ионов:С4 > С3> C2 > C1
(случай 2)
Дата публикования: 2015-11-01; Прочитано: 5415 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
