 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Классификация гормонов по химическому строению и биологическим функциям
|
|
Все гормоны классифицируют по химическому строению, биологическим функциям и механизму действия.
Классификация гормонов по химическому строению
По химическому строению гормоны делят на 3 группы: пептидные (или белковые), стероидные и непептидные производные аминокислот.
Классификация гормонов по химическому строению
| Пептидные гормоны | Стероиды | Производные аминокислот |
| Адренокортикотропный гормон (кортикотропин, АКТГ) | Альдостерон | Адреналин |
| Гормон роста (соматотропин, ГР, СТГ) | Кортизол | Норадреналин |
| Тиреотропный гормон (тиреотропин, ТТГ) | Кальцитриол | Трийодтиронин (Т3) |
| Лактогенный гормон (пролактин, ЛТГ) | Тестостерон | Тироксин (Т4) |
| Лютеинизирующий гормон (лютропин, ЛГ) | Эстрадиол | |
| Фолликулостимулирующий гормон (ФСГ) | Прогестерон | |
| Меланоцитстимулирующий гормон (МСГ) | ||
| Хорионический гонадотропин (ХГ) | ||
| Антидиуретический гормон (вазопрессин, АДГ) | ||
| Окситоцин | ||
| Паратиреоидный гормон (паратгормон, ПТГ) | ||
| Кальцитонин | ||
| Инсулин | ||
| Глюкагон |
Классификация гормонов по биологическим функциям
По биологическим функциям гормоны можно разделить на несколько групп. Эта классификация условна, поскольку одни и те же гормоны могут выполнять разные функции. Например, адреналин участвует в регуляции обмена жиров и углеводов и, кроме этого, регулирует частоту сердечных сокращений, АД, сокращение гладких мышц. Кортизол не только стимулирует глюконеогенез, но и вызывает задержку NaCl.
Классификация гормонов по биологическим функциям
| Регулируемые процессы | Гормоны |
| Обмен углеводов, липйдов, аминокислот | Инсулин, глюкагон, адреналин, кортизол, тироксин, соматотропин |
| Водно-солевой обмен | Альдостерон, антидиуретический гормон |
| Обмен кальция и фосфатов | Паратгормон, кальцитонин, кальцитриол |
| Репродуктивная функция | Эстрадиол, тестостерон, прогестерон, гонадотропные гормоны |
| Синтез и секреция гормонов эндокринных желёз | Тропные гормоны гипофиза, либерины и статины гипоталамуса |
| Изменение метаболизма в клетках, синтезирующих гормон | Эйкозаноиды, гистамин, секретин, гастрин, соматостатин, вазоактивный интестинальный пептид (ВИП), цитокины |
Клетки-мишени и клеточные рецепторы гормонов. Рецепторы цитоплазматических мембран, рецепторы, локализованные в цитоплазме. Регуляция количества и активности рецепторов. Механизмы трансдукции сигналов рецепторами мембран, G-белок.
Клетки-мишени - это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки.
Механизмы действия гормонов на клетки-мишени.
В зависимости от строения гормона существуют два типа взаимодействия. Если молекула гормона липофильна, (например, стероидные гормоны), то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет.
Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору.
Что такое посредники, которые участвуют во внутриклеточной передаче гуморальных сигналов? Это циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, кальций-связывающий белок - кальмодулин, ионы кальция, ферменты, участвующие в синтезе циклических нуклеотидов, а также протеинкиназы - ферменты фосфорилирования белков. Все эти вещества участвуют в регуляции активности отдельных ферментных систем в клетках-мишенях.
Регуляция количества и активности рецепторов
Концентрация рецепторов внутри клетки или на её поверхности и их сродство к данному гормону в норме регулируются различными способами, а также могут меняться при заболеваниях или при использовании гормонов или их агонистов в качестве лекарственных средств. Например, при воздействии β-адренергических агонистов на клетки в течение нескольких минут в ответ на новое добавление агониста прекращается активация аденилатциклазы, и биологический ответ исчезает. Такое снижение чувствительности рецептора к гормону (десенситизация) может происходить в результате изменения количества рецепторов по механизму понижающей регуляции. Гормон связывается с рецептором, комплекс гормон-рецептор путём эндоцитоза проникает в клетку (интернализуется), где часть рецепторов подвергается протеолитическому расщеплению под действием ферментов лизосом, а часть инактивируется, отделяясь от других мембранных компонентов. Это приводит к уменьшению количества рецепторов на плазматической мембране. Например, в случае инсулина, глюкагона, катехоламинов это происходит в течение нескольких минут или часов. При снижении концентрации гормона рецепторы возвращаются на поверхность клетки, и чувствительность к гормону восстанавливается. Активность рецептора, т.е. его сродство к гормону, может изменяться также в результате ковалентной модификации, главным образом путём фосфорилирования. Концентрация внутриклеточных рецепторов может также регулироваться по механизму индукции и репрессии.
G-белки (ГТФ-связывающие белки) - универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка,, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G-белка имеет специфические центры:
- связывания ГТФ или ГДФ;
- взаимодействия с рецептором;
- связывания с βγ-субъединицами;
- фосфорилирования под действием протеинкиназы С;
- взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
В структуре G-белков отсутствуют α-спиральные, пронизывающие мембрану домены. G-белки относят к группе "заякоренных" белков.
82. Циклические АМФ и ГМФ как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
- взаимодействие рецептора с сигнальной молекулой (первичным посредником);
- активация мембранного фермента, ответственного за образование вторичного посредника;
- образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+;
- активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказьюают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
Гуанилатциклаза катализирует образование цГМФ из ГТФ, одного из важных посредников внутриклеточной передачи сигнала (рис. 5-32, 5-33). Гуанилатциклаза находится в клетке, как в мембранносвязанном состоянии, так и в цитозольном.
Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого
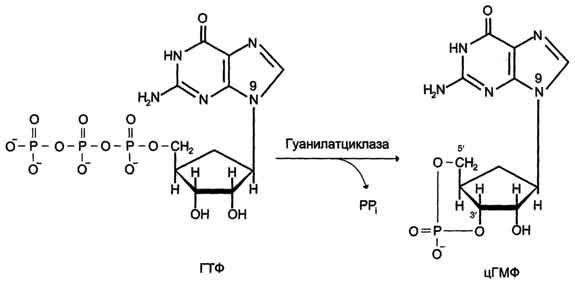
Рис. 5-32. Образование 3',5'-циклического ГМФ (цГМФ).
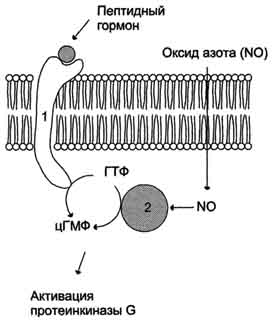
Рис. 5-33. Регуляция активности мембранной (1) и цитозольной (2) гуанилатциклазы.
кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени - лишь 20%. Цитозольная и мембранносвязанная гуанилатциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции.
Цитозольная форма гуанилатциклазы состоит из двух субъединиц (α и β) и содержит в своём составе простетическую группу - гем. В области гема связывается активатор этой формы гуанилатциклазы - оксид азота (NO), образующийся из аргинина под действием фермента синтазы оксида азота (см. раздел 9).
Мембраннсювязанная гуанилатциклаза - трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора к рецептору вызывает изменение конформации в мембранном и цитозольном доменах и, как следствие, активацию гуашиатциклазы. В тканях человека присутствуют 3 типа мембранносвязанных гуанилатциклаз, в активации которых принимают участие специфические регуляторы - предсердный натрийуретический фактор (ПНФ), натрийурети-ческий пептид из мозга и кишечный пептид гуанилин.
В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа G), цГМФ-регулируемые ионные каналы и цГМФ-регулируемая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ).
цГМФ играет важную роль в регуляции Са2+-гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления
рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+.
Аденилатциклаза
Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ (рис. 5-36), - ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs-Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, α-субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимулирует проявление ГТФ-фосфатазной

Рис. 5-36. Образование циклического аденозинмонофосфата (цАМФ).
активности α-субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы αs-ГДФ и αi-ГДФ, не комплементарные аденилатциклазе.
Из 8 изученных изоформ аденилатциклазы 4 - Са2+-зависимые (активируются Са2+). Регуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать активность двух основных вторичных посредников цАМФ и Са2+.
Дата публикования: 2015-11-01; Прочитано: 6259 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
