 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
5 страница. № 38 V2 Термодинамиканың бірінші бастамасының {изотермдік, изохоралық және изобаралық) процестерге
|
|
№ 38
| V2 | Термодинамиканың бірінші бастамасының {изотермдік, изохоралық және изобаралық) процестерге қолданылуы |
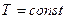 , , 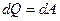
| |
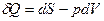 , , 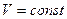
| |
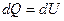 , , 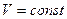
| |
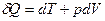 , , 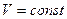
| |
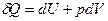 , P=const , P=const
| |
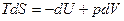 , V=const , V=const
| |
 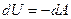
| |
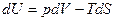 , V=const , V=const
|
№ 39
| V2 | Политроптық процестердегі{изохоралық, избаралық және адиабаталық} процестерге арналған жұмыстың формуласы |
| T= const: A = 0 | |
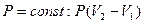
| |
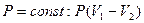
| |
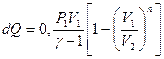
| |
| V=const: A = 0 | |
| T=const: A = 0 | |

| |
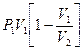 , , 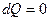
|
№ 40
| V2 | {Изохоралық, избаралық және изотермдік} процестер үшін политропа көрсеткіштері |
| T= const: n = 1 | |
| P=const: n = 0 | |
| T= const: n = 0 | |
P=const: n = 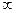
| |
V=const: n = 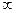
| |
| T= const: n = 2 | |
T= const: n = 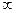
| |
| T= const: n = 1 |
№ 41
| V2 | Изобаралық процесте {біратомды,екіатомды және үшатомды} идеал газды 10 K температураға қыздыру кезінде 1 моль идеал газдың ішкі энергиясының өзгерісі |
| 124,65 Дж | |
| 55,4 Дж | |
| 249,3 Дж | |
| 83,1 Дж | |
| 202,75 Дж | |
| 150,65 Дж | |
| 1200 Дж | |
| 124,65 Дж |
№ 42
| V2 | Газдардағы T = const кезіндегі {h, l және D} коэффициенттерінің қысымға р тәуелділігінің дұрыс түрлері |
| h қысымға тәуелді емес | |
| l~ p | |
h~ 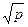
| |
h~ 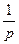
| |
| D~ p; | |
| l қысымға тәуелді емес | |
D~ 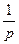
| |
l~ 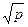
|
№ 43
| V2 | Газдардағы Р=const кезіндегі {h, l және D} коэффициенттерінің Т температураға тәуелділігінің дұрыс түрлері |
D ~ 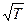
| |
h~ 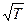
| |
| h температураға тәуелді емес | |
l~ 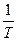
| |
| D температураға тәуелді емес | |
l~ 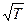
| |
| l температураға тәуелді емес | |
D ~ 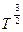
|
№ 44
| V2 | Политроптық процестердегі{изохоралық, избаралық және изотермдік} процестерге арналған жұмыстың формуласы |
| T= const: A = 0 | |
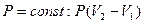
| |
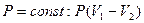
| |
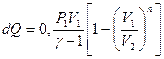
| |
| V=const: A = 0 | |
| T=const: A = 0 | |

| |
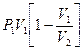 , , 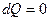
|
№ 45
| V2 | {Изохоралық, избаралық және изотермдік} процестер үшін жылусиымдылықтың дұрыс мәндері |
| V = const, C = C p | |
| V = const, C = C v | |
| V = const, C = 0 | |
| V = const, C = ±¥ | |
| p = const, C = C v | |
| p = const, C = C p | |
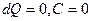
| |
| T = const, C = ¥ |
№ 46
| V2 | Қатты байланыстағы {біратомды, екіатомды, үшатомды} идеал газ молекулаларының ішкі энергиясының дұрыс формулалары |
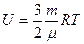
| |
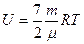
| |
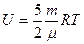
| |
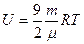
| |
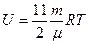
| |
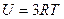
| |
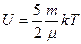
| |
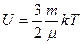
|
№ 47
| V2 | {Изохоралық, избаралық және адиабаталық} процестер үшін жылусиымдылықтың дұрыс мәндері |
| V = const, C = C p | |
| V = const, C = C v | |
| V = const, C = 0 | |
| V = const, C = ±¥ | |
| p = const, C = C v | |
| p = const, C = C p | |
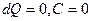
| |
| T = const, C = ¥ |
№ 48
| V2 | {Фик, Фурье, Ньютон} заңдарының математикалық жазылуы |

| |
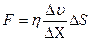
| |
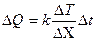
| |
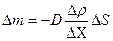
| |
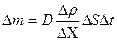
| |
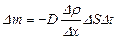
| |
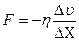
| |
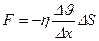
|
№ 49
| V2 | Тұрақты қысымдағы {гелий, азот және көмірқышқыл газдарының} молярлық жылусиымдылықтары |
| 120 кДж/(моль × К) | |
| 20,77 Дж/(моль × К) | |
| 1,2 кДж/(моль ×К) | |
| 29,05 Дж/(моль × К) | |
| 21 Дж/(моль ×К) | |
| 33,24 Дж/(моль ×К) | |
| 21 Дж(кмоль ×К) | |
| 25 Дж/(кмоль ×К) |
№ 51
| V2 | Диффузия D және тұтқырлық h коэффициенттерінің өзара байланыстыратын дұрыс формулалар |
| h = D×r | |
| D = h×r | |
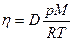
| |
| h = D× c v | |
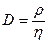
| |
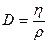
| |
| D×h = r | |
| h = D×r× c v |
№ 52
| V2 | Газдардағы тұтқырлық h және жылу сиымдылық l коэффициенттерінің өзара байланыстыратын дұрыс формулалар |
| l = h×r | |
| h = l×r | |
| l = h×c v | |
| h = l×c v | |
| l = h×r×c v | |
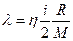
| |
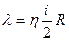
| |
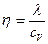
|
№ 53
| V2 | Бір моль идеал газ үшін {изотермдік, изобаралық және изохоралық} процестерге арналған энтропия өзгерісінің дұрыс формулалары |
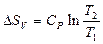
| |
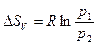
| |
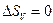
| |
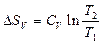
| |
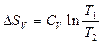
| |
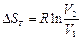
| |
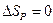
| |
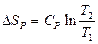
|
№54
| V2 | Бір моль идеал газдың температурасы {изобаралық изохоралық және адиабаталық}процестерде е = 2,7 есе артқандағы энтропияның өзгерісі |
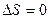
| |
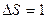
| |
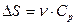
| |
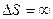
| |
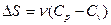
| |

| |
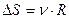
| |
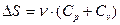
|
№ 55
| V2 | Бастапқы температурасы 300 К, 20 г сутегі (H 2) изобаралық жағадайда көлемін екі есе ұлғаю кезіндегі: газдың ұлғаю жұмысын, ішкі энергиясының өзгерісі және газға берілген жылу мөлшері |
| 20,233 кДж | |
| 24,932 кДж | |
| 60,361 кДж | |
| 62,325 кДж | |
| 21,334 кДж | |
| 87,255 кДж | |
| 80,255 кДж | |
| 82,332 кДж |
№ 56
| V2 | 4 моль көмір қышқыл газы (CO 2) тұрақты қысымда 100 К температураға дейін қыздырылған. Осы газдың ұлғаю жұмысын, ішкі энергиясының өзгерісін және газға берілген жылу мөлшерін табыңыз? |
| 3,324 кДж | |
| 4,932 кДж | |
| 9,972 кДж | |
| 6,325 кДж | |
| 11,334 кДж | |
| 13,296 кДж | |
| 15,255 кДж | |
| 12,332 кДж |
№ 57
| V2 | Идеал газдың тығыздығына r арналған дұрыс формуласы (М- газдың молярлық массасы) |
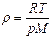
| |
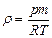
| |
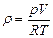
| |
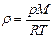
| |
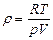
| |
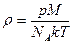
| |
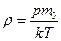
| |

|
№ 58
| V2 | Өлшемсіз жылдамдық 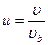 арқылы жазылған, жылдамдықтың модуліне арналған Максвеллдің үлестірім заңының дұрыс формуласы арқылы жазылған, жылдамдықтың модуліне арналған Максвеллдің үлестірім заңының дұрыс формуласы
|
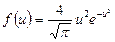
| |
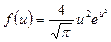
| |
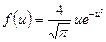
| |

| |
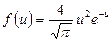
| |
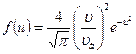
| |
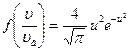
| |
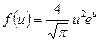
|
№ 59
| V2 | Барометрлік формуланың дұрыс өрнегі (m – ауа молекуласының массасы, M – ауаның молярлық массасы) |
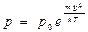
| |

| |
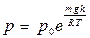
| |
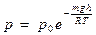
| |
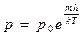
| |

| |
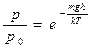
| |
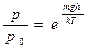
|
№ 60
| V2 | Газдардағы {изотермдік, изохоралық және изобаралық} процестерге арналып жазылған термодинамиканың бірінші заңы |
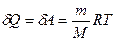 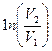
| |
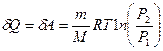
| |
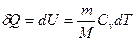
| |
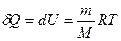
| |

| |
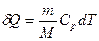
| |
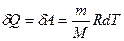
| |
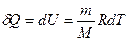
|

№ 61
| V2 | Газдардағы {изотермдік, изохоралық және адиабаталық} процестерге арналып жазылған термодинамиканың бірінші заңы |
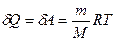 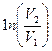
| |
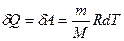
| |
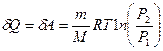
| |
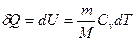
| |

| |
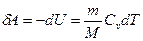
| |
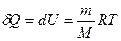
| |
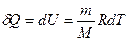
|
№ 62
| V2 | Больцман үлестіріміне арналған дұрыс формула (Еп – сыртқы күш өрісіндегі бір молекуланың потенциальдық энергиясы) |
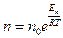
| |
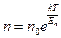
| |
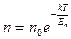
| |
| 1 | 
|
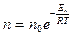
| |
| 1 | 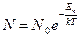
|
| 1 | 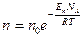
|
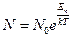
|
№ 63
| V2 | Жүйе 1-ші күйден 2-ші күйге көшкенде газдың {V мен P} өзгерісі
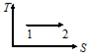  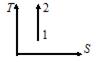
|
| Артады | |
| Белгісіз | |
| Өзгермейді | |
| газдың массасын білу қажет | |
| әртүрлі газдар үшін жауап әртүрлі | |
| Кемиді | |
| Артады | |
| Кемиді |
№ 64
| V2 | Парциал диффузия  коэффициенттерін D12 өзара диффузия коэффициентімен байланыстратын Майер формуласы коэффициенттерін D12 өзара диффузия коэффициентімен байланыстратын Майер формуласы
|
| D 12 = c 1×D 2 + c 2×D 1 | |
| D 12 = c 1×D 1+ c 2×D 2 | |
| D 12 = c 1×D 2 -c 2×D 1 | |
| D 12 = c 1×D 1 - c 2×D 2 | |
| D 12 = D 1+ D 2 | |
| D 12 =(1- c2 ) c 2×D 1 | |
D 12 = c 1×D 2 +(1- c1)× 
| |
D 12 = 
|
Дата публикования: 2015-11-01; Прочитано: 1479 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
