 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вывод основного уравнения МКТ. Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём
|
|
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим скорость движения vx, тогда перед столкновением со стенкой сосуда импульс частицы равен mvx, а после — − mvx, поэтому стенке передается импульс p = 2 mvx. Время, через которое частица сталкивается с одной и той же стенкой, равно 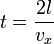 .
.
Отсюда следует: 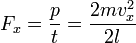
Так как давление 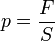 , следовательно сила F = p * S
, следовательно сила F = p * S
Подставив, получим: 
Преобразовав: 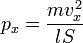
Так как рассматривается кубический сосуд, то V = Sl
Отсюда: 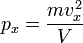 .
.
Соответственно,  и
и 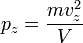 .
.
Таким образом, для большого числа частиц верно следующее: 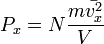 , аналогично для осей y и z.
, аналогично для осей y и z.
Поскольку 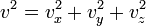 , то
, то  . Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
. Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
Отсюда 
или 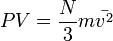 .
.
Пусть 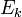 — среднее значение кинетической энергии всех молекул, тогда:
— среднее значение кинетической энергии всех молекул, тогда:  , откуда
, откуда 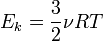 .
.
Для одного моля выражение примет вид 
Число степеней свободы молекулы. Число независимых координат, которые полностью определяют положение тела в пространстве, называется числом степеней свободы тела. Материальная точка имеет три степени свободы. Твёрдое тело произвольной формы - 6 (3 поступательных, три вращательных). 1. Одноатомная молекула - 3. 2. Двухатомная молекула - 5. 3. Трёхатомная молекула -7.
Закон распределения энергии по степеням свободы. На каждую степень свободы приходится в среднем одинаковая кинетическая энергия, равная 1/2kT. 1. Средняя энергия одной молекулы <e>=i(kT/2). 2. Внутренняя энергия одного моля газа. Um=<e>NA=(i/2)kNAT. 3. Внутренняя энергия произвольной массы газа. U=(m/M)UM=(m/M)(i/2)RT.
Внутренняя энергия идеального газа. U=N<e>, <e> - средняя кинетическая энергия молекул. <e>=(i/2)(kT), где k=1,38×10-23Дж/К, i - это сумма числа поступательных, вращательных и колебательных степеней свободы молекул. i=iпост.+ iвращ.+2iкол..
14. Работа газа при расширении. Количество теплоты. Первое начало термодинамики.
Работа газа при расширении. 1. Изобарный процесс. p=const, A=p(V2-V1). 2. Изотермический процесс. t=const, A=(m/M)RT×ln(V2/V1). 3. Адиабатный процесс. dQ=0 A=(m/M)Cv(T2-T1) или A=((m/M)(RT1)/(g-1))(1-(V1/V2)g-1).
Количество теплоты Q определяет количество энергии, переданной от тела к телу путём теплопередачи. Теплопередача - это совокупность микроскопических процессов, приводящих к передачи энергии от тела к телу. Q=U1-U2+A, где U1 и U2 - начальные и конечные значения внутренней энергии системы.
Первое начало термодинамики. Количество тепла, сообщённого системы идёт на приращение внутренней энергии системы и совершение работы над внешними телами. DQ=DU+DA. 1. При изобарном процессе Q=DU+A=nCvDT+nRDT. 2. При изохорном процессе A=0 Q=DU=nCvDT. 3. При изотермическом процессе DU=0 Q=A=nRDT×ln(V2/V1). 4. При адиабатном процессе Q=0 A=-DU=-nCvDT.
15. Классическая молекулярно-кинетическая теория теплоемкости. Удельная и молярная теплоемкости. Формула Майера. Границы применимости теории.
Дата публикования: 2015-11-01; Прочитано: 499 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
