 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон Максвела для распределения молекул газа по скоростям.средняя арифметическая,средняя квадратичная и наиболее вероятные скорости газовых молекул
|
|
Внутряняя энергия идеального газа
Внутренняя энергия любого вещества (в том числе и газа) - это сумма кинетических и потенциальных энергий всех молекул.
Идеальный газ - это модель реального газа, в которой молекулы принимаем за материальные точки (т. е. не учитываем размеры молекул) и пренебрегаем взаимодействием молекул друг с другом. Поэтому внутренняя энергия идеального газа равна только сумме кинетических энергий молекул (потенциальная энергия взаимодействия молекул равна 0). У реального газа потенциальная энергия взаимодействия молекул не равна 0, и она вносит вклад в выражение для внутренней энергии.В соответствии с кинетической теорией, распределение энергии по степеням свободы равномерное. У поступательного движения 3 степени свободы. Следовательно, на одну степень свободы движения молекулы газа будет приходиться 1/3 ее кинетической энергии
закон Максвела для распределения молекул газа по скоростям.средняя арифметическая,средняя квадратичная и наиболее вероятные скорости газовых молекул.
Молекулы газа даже в равновесии движутся беспорядочно, сталкиваясь между собой и со стенкой сосуда, беспрерывно меняя свою скорость. Это означает, что в каждый момент времени в газе есть молекулы, которые имеют самые различные скорости. Вместе с тем, поскольку давление и температура в газе остаются постоянными, то, как бы не менялась скорость молекул, среднее значение ее квадрата остается постоянным. Это оказывается возможным лишь при наличии неизменного во времени и одинакового во всех частях сосуда распределения молекул по скоростям.
 Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от
температуры.
Скорости, характеризующие состояние газа: 1) наиболее вероятная
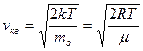
2) средняя арифметическая
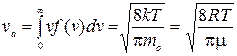
3) средняя квадратичная
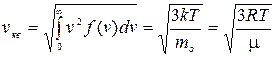
Дата публикования: 2015-11-01; Прочитано: 310 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
