 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Виды химической связи
|
|
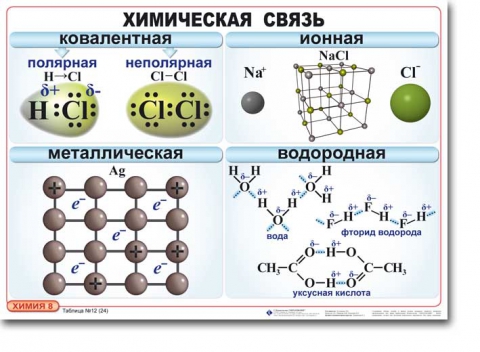
К основным характеристикам химической связи, дающим информацию о структуре молекулы и ее прочности, относятся валентный угол, длина, полярность и энергия связи.
Длиной связи называют расстояние между центрами атомов, образующих данную связь (межъядерное расстояние). Ее определяют экспериментально при помощи различных физико-химических методов. Длина связи обусловлена размером реагирующих атомов и степенью перекрывания их электронных облаков, которая зависит от типа химической связи. Надо обратить внимание, что длина связи всегда меньше суммы радиусов элементов, т.к. происходит перекрывание атомных орбиталей, а не их касание.
Длина связи от этана к ацетилену уменьшается, т.к. увеличивается кратность (порядок) связи от одинарной к тройной. Чем больше кратность связи, тем меньше длина связи.
В ряду галогеноводородов длина связи Н‑Г имеет следующие значения (в пм, 1 пм = 10-12 м):
| Соединение | H-F | H-Cl | H-Br | H-I |
| Длина связи |

Другой характеристикой химической связи, отражающей геометрическое строение, является валентный угол.
Он зависит от природы атомов и характера химической связи.
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Эта величина является характеристикой прочности связи. Ее выражают в кДж/моль образующегося вещества.
Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине, но противоположных по знаку зарядов (q+ и q‑), находящихся на расстоянии l (длина диполя) друг от друга. Полярность молекулы оценивается значением электрического момента диполя m=  . Электрический момент диполя представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы. Молекула СО2 имеет линейное строение и, несмотря на полярность связи С=О, вследствие взаимной компенсации электрических моментов диполя, молекула СО2 неполярна (m=0). В угловой молекуле воды полярные связи О-Н располагаются под углом 104,5°, взаимной компенсации не происходит и молекула воды полярна (m=0,61×10-29 Кл×м).
. Электрический момент диполя представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы. Молекула СО2 имеет линейное строение и, несмотря на полярность связи С=О, вследствие взаимной компенсации электрических моментов диполя, молекула СО2 неполярна (m=0). В угловой молекуле воды полярные связи О-Н располагаются под углом 104,5°, взаимной компенсации не происходит и молекула воды полярна (m=0,61×10-29 Кл×м).
Дата публикования: 2015-10-09; Прочитано: 2334 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
