 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторная работа № 11. Определение отношения теплоемкостей газа
|
|
Определение отношения теплоемкостей газа
Выполнил студент _______________, группа __________, дата ____________.
Допуск ______________
Выполнение __________
Зачет ________________
Цель работы: Найти величину отношения CP /CV для воздуха.
Приборы и материалы
| № п\п | Наименование прибора | Цена деления | Предел измерения (х max) | Точность отсчета (Δ х пр) |
| Закрытый стеклянный баллон с двумя трубками и краном | - | - | - | |
| Манометр | ||||
| Ручной нагнетательный насос | - | - | - |
Теоретические сведения
Основные понятия и законы
Теплоёмкость
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
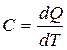
Единица измерения теплоёмкости в СИ — Дж/К.
Теплоемкость тела зависит только от его химического состава, массы, вида термодинамического процесса, в широком интервале температур – от температуры.
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Удельная и молярная теплоёмкости
Удельной теплоемкостью вещества называется физическая величина, численно равная количеству энергии в форме теплоты, которое надо сообщить единице массы этого вещества для увеличения его температуры на 1 Кельвин (т.е. это теплоёмкость, отнесённая к единице массы вещества):
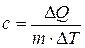 , Дж/(кг×К)
, Дж/(кг×К)
В общем случае удельная теплоемкость зависит от рода вещества и от вида термодинамического процесса, в котором телу сообщается количество теплоты.
Удельные теплоёмкости многих веществ приведены в справочниках (обычно для процесса при постоянном давлении). К примеру, удельная теплоёмкость жидкой воды при нормальных условиях — 4200 Дж/(кг·К);
льда – 2100 Дж/(кг·К).
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними. Поэтому для газов различают два вида теплоемкостей: если газ нагревают, сохраняя его объем постоянным (изохорно), говорят об удельной теплоемкости газа при постоянном объеме c V; если же газ нагревают, сохраняя постоянным его давление (изобарно), то говорят об удельной теплоемкости газа при постоянном давлении с Р. У жидкостей и твёрдых тел разница между Ср и Cv сравнительно мала.
Часто пользуются молярной теплоемкостью Сμ, которая, в отличие от удельной теплоемкости, отнесена не к единице массы (1 килограмму), а к массе одного моля вещества. Очевидно, что
Cμ = m c, Дж/(моль×К)
Для газов молярную теплоемкость, рассчитанную при постоянном давлении, обозначают С Р, а рассчитанную при постоянном объеме – С V. Следовательно, С Р = m× c P, C V = m× c V.
Когда нагревание газа происходит при постоянном объеме, газ не совершает механической работы и все сообщаемое газу тепло идет только на увеличение его внутренней энергии D U, т.е.:
D Q = m × c V×D T = D U.
Если же нагревание газа происходит при постоянном давлении и, следовательно, объем газа увеличивается, то сообщаемое газу тепло D Q идет как на увеличение его внутренней энергии D U, так и на совершение газом работы D A над внешними телами, т.е. D Q = m × c P×D T = D U + D A.
Из сопоставления формул следует, что c P > c V, т.е. удельная теплоемкость газа при постоянном давлении больше удельной теплоемкости того же газа при постоянном объеме. При этом, согласно уравнению Майера:
C P = C V + R.
В данной работе требуется определить не абсолютные значения теплоемкостей газа, а их отношение, называемое коэффициентом Пуассона:
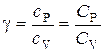 .
.
Теоретическое вычисление теплоемкости, в частности её зависимости от температуры тела, не может быть осуществлено с помощью чисто термодинамических методов и требует применения методов статистической физики.
Теплоёмкость идеального газа
Для газов вычисление теплоемкости сводится к вычислению средней энергии теплового движения отдельных молекул. Это движение складывается из поступательного и вращательного движений молекулы как целого и из колебаний атомов внутри молекулы.
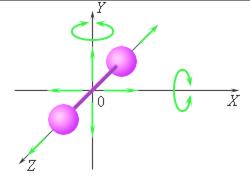
|
| Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы. |
| Рис. 1 |
На рис.1 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула.
Каждое независимое движение называется степенью свободы. Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные). В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 1\2 kT,
где k = 1,38×10- 23 Дж/К – постоянная Больцмана.
Из этой теоремы следует, что молярные теплоемкости газа C p и C V и их отношение γ могут быть записаны в виде
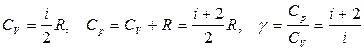
где i – число степеней свободы молекулы газа.
Для газа, состоящего из одноатомных молекул (i = 3):

Для газа, состоящего из двухатомных молекул (i = 5):
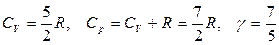
Для газа, состоящего из многоатомных молекул (i = 6):
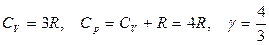
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле.
Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле.
Дата публикования: 2015-10-09; Прочитано: 969 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
