 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Технолог-й режим каталитич.процессов.Приемы теплообмена в контактных ап-тах
|
|
Катализом наз-ся увеличение скорости хим. реакций или возбуждение их при воздействии вещ-в-катализаторов, кот. участвуют в реакции, вступая в промежуточное хим. взаимодействие с реагентами, но восстанавливают свой хим. состав с окончанием акта катализа.Технолог. приемы для увеличения скорости процесса различны для кинетической и диффузионной областей. Так, скорость хим. стадий в первую очередь зависит от активности кат-ра и тем-ры. Диф. процессы ускоряются с повыш. тем-ры в меньшей степени, чем хим-ие. Внешняя диффузия ускоряется турбулизацией потока реагирующей смеси, а диффузия к внутренней части зерен кат-ра облегчается за счет измельчения зерен и увел. их пористости. Повыш. концентрации реагирующих вещ-в или давления ускоряет как диф-ые, так и кинетич. стадии катализа.Время нахождения реакц. смеси в зоне кат-ра, так называемое время контакта, сказывается на каталитич. процессе.Увел. времени контакта для необратимых каталитич. процессов снижает суммарную скорость процесса, но выход продукта при этом увел-ся так же, как и для некаталитич. процессов. Температурный режим при наличии кат-ра определенной активности более всего влияет на скорость каталитич. процесса. Для процессов, протекающих в кинетической области, повышение тем-ры всегда увел-ет скорость достижения равновесия,но равновес. выход с ростом тем-ры изменяется по-разному, в зав-ти от знака теплового эффекта реакции.Выход продукта эндотермической катал-ой реакции увел-тся с повышением тем-ры в соответствии с принципом Ле Шателье.Действительный X и равновесный XP выходы в эндотермич. процессах изм-ся по одному закону.Однако при прочих равных условиях X ниже равновесного при низких тем-рах и сближается с равновесным при более высоких тем-ах. Это видно на типичной эндотермической катал-ой реакции взаимодействия метана с водяным паром на никелевом катализаторе по ур-ю:СН4+Н2О→СО+ЗН2+∆H
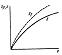
Для достижения максималь. выхода продукта и высоких скоростей эндотермич. катал-го процесса необходимо повышать тем-ру.Однако это можно делать до тех пор, пока подъем тем-ры не начнет сказываться на термостойкости сырья и продуктов реакции, конструкц. материалов, и т. п..Эти закономерности хар-ны для многих эндотермич. катал-их реакций:конверсии углеводородов с водяным паром, дегидратации и др. Для обратимых экзотермич. катал-их реакций, так же как и для обычных реакций с повышением тем-ры равновес. выход продукта уменьшается, а действительный имеет максимум в области оптималь. тем-р.И абсолютный максимальный выход,и соответствующая ему оптималь. тем-ра зависят от условий проведения процесса и от активности катал-ра,концентрации реагир. вещ-в и времени контактирования.(Рис.62.Зав-ть выхода продукта Х от тем-ры при различ.времени контактирования τ1> τ2> τ3> τ4> τ5(экзотермич.процесс))Рис.63.Зав-ть выхода продукта Х от тем-ры для кат-ров различ.активности А1> А2> А3> А4(экзотермич.процесс)


На рис. 62 показано изменение положения кривых, связывающих фактический выход продукта Х с тем-рой при различном времени контакта τ(тем-ра зажигания катализатора ТЗ и другие параметры технол-го режима считаются неизменными). Если соединить точки максимальных выходов для каждого времени контактирования, то получится кривая оптималь. темп-р.Она показывает, что с увел. τ для получения максимального выхода продукта Х следует снижать тем-ру процесса..Однако влияние тем-ры не всегда так четко выражено.Так при повышении тем-ры сверх некоторого предела для каталитнч. реакции окисления аммиака, синтеза метанола и этанола начинают протекать вредные побочные реакции. Давление влияет на выход продукта катал-го превращения в соответствии с принципом Ле Шателье.Поэтому повышенное и высокое давление очень широко применяют во многих промыш. катал-их процессах.Так, давление становится решающим фактором, когда активность катал-ра и равновесный выход продукта невелики, как это наблюдается в процессах синтеза аммиака и метанола.Зав-ть выхода продукта от давления приведена на рис. 64.Зав-ть выхода продукта от давления:ХР-равновесный выход, Х-действитель.выход.
Ход кривой типичен для многих газовых катал. реакций, идущих с уменьшением объема. Для некоторых катал-их реакций, протекающих с увел-ем газового объема,фактором, повышающим равновес. выход, яв-ся понижение давления. Поэтому некоторые процессы дегидрирования, дегидрации и другие ведут под вакуумом. Концентрация реагирующих компонентов влияет на скорость катал. реакции так же, как и на скорость обычных хим. превращений.Однако чрезмерное повышение концентрации реагентов недопустимо из-за ряда причин. Например, при высокой экзотермичности процесса и трудности отвода теплоты может произойти термическая порча катализатора(окисление SO2), или реакционная смесь становится взрывоопасной (окисление NH3). Контактные ап-ты. Аппаратура гомогенного катализа не требует спец. конструкции, аппаратура гетерогенного катализа,и особенно контактные ап-ты,в которых газообразные реагенты взаимод-ют на твердых кат-рах, специфична и разнообразна. Контактные ап-ты должны работать непрерывно, обладать высокой интенсивностью, обеспечивать тем-ный режим процесса, близкий к оптимальному. Конструкции контактных ап-ов различаются в зав-ти от способа контакта газов с кат-ром, подвода или отвода теплоты и т. п.: 1) ап-ты поверхностного контакта (катализ на стенках, трубках, катал-ных сетках);2) ап-ты с фильтрующим слоем кат-ра;3) ап-ты со взвешенным (псевдоожиженным) слоем кат-ра;4) ап-ты с пылевидным движущимся ката-ром.Во всех этих ап-тах теплообмен может осущ-ся различ.способами: через внешние (выносные) теплообменники, через теплооб-ки, встроенные в контактный ап-т (внутренний теплооб-к), и т. п.Ап-ты последнего типа бывают двух видов:полочные и трубчатые. Полочные и трубчатые контактные ап-ты с фильтрующими слоями катал-ра наиболее широко применяются в хим. промыш-ти.Достижение оптималь.тем-ры катал-го процесса -важнейшее условие нормальной работы всего контактного узла. Оно обеспеч-ся компоновкой теплооб-ков и контактных ап-ов и выбором конструкций катал. реакторов.Различные приемы теплообмена в контактных ап-ах показаны на рис.65.Приемы теплообмена в контактных ап-ах и узлах:а-адиабатические слои кат-ра с промеж-ым теплообменом;б — добавление холодного реагента между слоями катал-ра;в—одновременная циркуляция реагента и инертного хладоагента;г -косвенный теплообмен;д--прямой теплообмен;е — теплообмен во взвешенном слое катал-ра; А,В — исходные реагенты;D — продукты реакции;Хл — хладоагент.

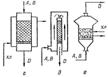
Выбор типа реактора определяется характером катал-го процесса, производительностью узла, свой-ми кат-ра и др.Чаще всего контактные ап-ты работают при выс. тем-рах и в агрессивной среде.Поэтому при их изготов-ии прим-ся легир. стали и спец. материалы, кислотостойкие и жаростойкие футеровки.
25)Активность и избирательность каталитич.процессов.
Катализом наз-ся увеличение скор-и хим. реакций или возбуждение их при воздействии вещ-в-кат-ров, которые участвуют в реакции, вступая в промежуточное хим. взаимодействие с реагентами, но восстанавливают свой хим. состав с окончанием акта катализа..По принципу фазового состояния реагентов и кат-ра катал-ие процессы разделяют на две основные группы: гомогенные и гетерогенные. При гомогенном катализе и кат-р, и реагенты нах-ся в одной фазе — газовой или жидкой. При гетерогенном катализе кат-р и реагенты или продукты реакции нах-ся в разных фазах;обычно применяются твердые кат-ры. Переходным от гомогенного к гетерогенному явл-ся микрогетерогенный катализ, при котором кат-р находится в коллоидном состоянии. Сущность ускоряющего действия кат-ов состоит в понижении энергии активации Е хим. реакции в результате изменения реакц. пути с участием кат-ра или осущ-ия реакции по цепному механизму при инициирующем действии кат-ра.Однако в некоторых типах кат-их реакций одновременно с понижением Е происходит уменьшение предэкспоненциального множителя k0 в Ур-ии Аррениуса:k=k0exp(-E/RT)Из-за этого повышение константы скорости кат-ой реакции несколько замедляется.Ускоряющее действие кат-ов отличается от действия других факторов:тем-ры, давления и концентрации реагентов.Кат-ры не смещают равновесия в системе, поскольку увел-ют скорость прямой и обратной реакций одинаково.Но так как прямая и обратная реакции ускоряются, равновесие достигается быстрее.Кат-р со временем изм-ся и после определ. срока службы может полностью необратимо потерять свою активность-это мера ускоряющего действия его на данную реакцию.В зав-ти от условий активность кат-ра выражают энергией активации, или разностью скоростей катал-ой и некат-ой реакций, или выходом целевого продукта основной реакции при заданных параметрах технол-го режима.Наиболее часто активность А кат-ра представляют как отношение константы скорости реакции с применением кат-ра kК к константе скорости некат-ой реакции k при одинаковых параметрах технол-го режима:концентрации реагентов,тем-ре, давлении и пр.При одинаковых значениях предэкспоненталь.множетеля:А=kK/k=exp(-EK/RT)/ exp(-E/RT)=exp(∆E/RT),где ∆E-разность энергий активации некаталитич. Е и каталитич. ЕК реакций: ∆E=Е-ЕК. Активность зависит от многих факторов:состава, величины и характера поверхности твердого кат-ра, параметров технол-го режима.При постоянстве движущей силы хим. реакции активность кат-ра определяется по формуле:А = ик-и (1-φк), где иК и и —скорость хим. реакции в присутствии кат-ра и без него; φк —доля объема реакц. пространства,занятая кат-ром и недоступная для реагир. вещ-в.Для сравнения активности кат-ра какой-либо хим. реакции в разных условиях активность можно выразить через интенсивность катал-го процесса, т. е. A = GП/υτ,где GП- кол-во продукта, полученное за время τ;υ— объем, занимаемый кат-ром (насыпной объем).Чем выше активность кат-ра, тем при более низкой тем-ре можно проводить процесс.Минимальная тем-ра реакц. смеси, при которой процесс начинает протекать с достаточной скор-ю, наз-ся тем-рой зажигания.С практической точки зрения благоприятны процессы, протекающие при более низкой тем-ре зажигания, которая зависит в основном от активности кат-ра и состава реакционной смеси.Все кат-ры работают в опред. тем-ном интервале.Нижний предел-тем-ра зажигания.Верхний предел опред-ся термич. устойчивостью кат-ра, исход. вещ-в и продуктов реакции. Важным свойством кат-ров яв-ся их отравляемость, т. е. частичная или полная потеря активности под действием посторонних примесей в реакц. смеси,называемых контактными или кат-ми ядами. Наиболее типичные яды:соединении серы,в кот. сера имеет неподеленные электронные пары:H2S, CS2, меркаптаны и др.;синильная кислота HCN, оксид углерода, соли ртути, соединения фосфора, мышьяка,свинца и др.Кат-р отравляется из-за сорбции яда на поверхности кат-ра.Т.к сорбция может быть обратимой и необратимой, отравляемость катализатора также бывает обратимая и необратимая. Кат-р может терять свою активность и при уменьшении активной поверхности из-за спекания или частич/ оплавления поверх-ти кат-ра,а также в результате осаждения на кат-кой поверхности твердых продуктов реакции или пыли.Поэтому реакц. смеси очищают от механ. твердых примесей и кат-рных ядов.Некоторые кат-ры обладают избирательностью (селективностью) действия, т. е. из нескольких термодинамически возможных ускоряют лишь одну целевую реакцию. При этом тем-ра протекания катализируемой реакции понижается, вследствие чего другие возможные реакции не идут.
Избирательность (селективность) действия кат-ра Iкат можно определить как отношение скорости образования целевого продукта к суммарной скорости превращения основного исходного реагента по всем направлениям:Iкат=dGП/[(νП/νИСХ )(1-dGИСХ)], где GП—кол-во продукта;GИСХ—кол-во основного исходного реагента; νП/νИСХ —соотношение стехиометр-ких коэф-тов при образовании продукта из основного исходного вещ-ва.Общую (интегральную) селективность действия кат-ра можно определить по формуле:IКАТ=GП/G=GП/(GП+GПОБ),где GП — кол-во основного реагента, превращенное в целевой продукт; GПОБ —кол-во исходного реагента, вступившего в побочные реакции;G—общее кол-во основного исходного реагента.
Дата публикования: 2015-10-09; Прочитано: 274 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
