 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Явление коагуляции
|
|
Коагуляция — процесс слипания частиц дисперсной фазы с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении его окраски, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы.
Коагуляция происходит вследствие полной или частичной потери защитного слоя, например двойного электрического слоя. Её можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита.
Коагуляция при нагревании происходит, потому что, во-первых, кинетическая энергия частиц возрастает и электростатическое отталкивание диффузных слоев при сближении мицелл не может препятствовать соприкосновению частиц. Во-вторых, при повышении температуры в результате десорбции (процесс, обратный адсорбции) уменьшается количество потенциалопределяющих ионов; следовательно, уменьшается число противоионов, в том числе, и в диффузном слое, который становится тоньше и перестает выполнять защитную функцию.
Наиболее изучена коагуляция электролитами. Минимальная концентрация электролита, достижение которой в коллоидном растворе вызывает коагуляцию золя, называют порогом коагуляции.
Порог коагуляции оценивается как молярная концентрация эквивалента вещества-коагулянта, измеряется в ммоль экв/л (по ранее применявшейся терминологии — «нормальная концентрация», мг-экв/л) и может быть рассчитан по формуле:
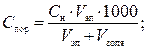 (5)
(5)
где С н — молярная концентрация эквивалента вещества в добавленном электролите-коагулянте, моль экв/л; V эл и V золя — соответственно объёмы добавленного электролита и исходного золя, л;
1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Коагуляция электролитами подчиняется правилам Шульце—Гарди*, которые можно сформулировать следующим образом:
1) коагуляцию вызывает ион, заряженный противоположно грануле золя;
2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие.
Механизм действия электролитов основан на том, что увеличение общей концентрации ионов в растворе приводит к сжатию диффузного слоя противоионов вокруг мицеллы, причем действие оказывают преимущественно ионы коагулянта, имеющие одинаковый заряд с ионами диффузного слоя. С увеличением заряда z коагулирующего иона его действие многократно возрастает. Количественно второе правило Шульце—Гарди выражается зависимостью:
С пор~  (6)
(6)
Следовательно, для одно-, двух-, и трехзарядного ионов пороги коагуляции будет относиться друг к другу как
 ,
,
а соотношение объёмов электролитов, которые надо добавить для достижения коагуляции, будет обратным.
Дата публикования: 2015-09-17; Прочитано: 2418 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
