 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Определение последовательности и нуклеотидного состава
|
|
Определенные сложности при определении нуклеотидной последовательности вызваны тем, что имеется всего четыре кодирующих "буквы" и существует высокая вероятность самопроизвольного разрыва молекул по сахарофосфатному остову, даже в результате очень аккуратного пипетирования, из-за их огромных размеров. Долгое время это сдерживало работы по определению полной нуклеотидной последовательности человеческого генома.
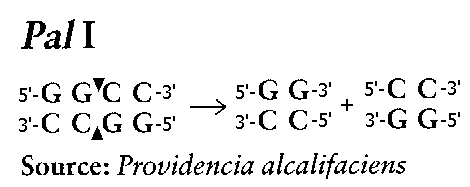
Перед определением полинуклеотидной последовательности молекулы НК “разрезают” на более мелкие участки, которые затем разделяют, как правило, электрофорезом на полиакриламидном геле (ПААГ, PAGE, SDS-PAGE) или капиллярным электрофорезом (CE). При "резке" НК применяют, главным образом, особого рода ферменты, выделенные из различных микроорганизмов, которые называют "рестирикционными энзимами" или просто РЕСТРИКТАЗАМИ. Другое их наименование (более научное)- ЭНДОНУКЛЕАЗЫ. В настоящее время доступно большое число коммерческих рестриктаз. Название рестриктазы складывается из латинских букв и цифр, отражающих лишь их происхождение (буквы) и разновидность (цифры). Например, эндонуклеаза Pst I находит последовательность нуклеотидов CTGCAG на одной из цепей (на комплементарной цепи ей соответствует последовательность GACGTC) и разрезает каждую из цепей между нуклеотидами А и G. В результате получаются отрезки ДНК с "липкими" концами:

Название Pst I образуется из названия источника энзима- микроорганизма Providencia stuartii.
Существуют эндонуклеазы, разрезающие ДНК с образованием тупых концов, например:
| СЕКВЕНИРОВАНИЕ ДНК |
· ПРОЦЕДУРА СЕЙНДЖЕРА
I. ПРОЦЕДУРА МАКСАМА-ГИЛБЕРТА (MAXAM-GILBERT, late 1970’s)
Процедура начинается с получения участка ДНК при расщеплении ее двумя различными рестриктазами. При этом образуются нетождественные “липкие” концы. Полученный двунитевой фрагмент ДНК после очистки на ПААГ делится на две порции, каждая из которых маркируется селективно радиоактивными нуклеотидами, комплементарными крайнему основанию на 5’-конце.
Реакция катализируется фрагментом ДНК-Полимеразы 1 бактерии E.Coli, (Klenow Fragment). Фрагмент Кленова получается частичным протеолизом ДНК-Полимеразы 1 E. Coli и обладает лишь активностью катализировать продолжение полинуклеотидной цепи в направлении 5’-3’. Немеченная радиоактивностью цепь далее в регистрации не будет видна. Проба делится на 4 части и обрабатывается химически с целью разрушения одного или двух азотистых оснований. На сегодняшний день есть возможность селективно разрушать либо только пуриновые основания (А+Т), либо только пиримидиновые (С+G), либо только Гуанин (G), либо только Цитозин (С). Пока не найдено способа разрушения только А или только Т. Разрушение происходит случайным образом. Далее проводят разрыв фосфоэфирных связей пиперидином, которое протекает только по местам разрушенных оснований:

При этом получаются детектируемые по радиоактивности отрезки, которые разделяются электрофорезом на ПААГ. Более короткие цепи продвигаются быстрее по гелю, более тяжелые - медленнее. Идентификация полос осуществляется авторадиографом.
II. ПРОЦЕДУРА СЭЙНДЖЕРА
1. Выделяется фрагмент однонитевой ДНК, последовательность в которой следует определить и к ней пришивается так называемый “универсальный праймер”, помеченный радиоактивностью 32Р или 35S.
Образец делится на 4 части и помещается в пробирки, в каждой из которых имеются все 4 трифосфонуклеотида (dTNP) и по одному дидеоксинуклеотиду (ddTNP), у которого отсутствует гидроксил при 3’ атоме углерода рибозы, следовательно, за ней продолжение цепи невозможно.


Дидеоксинуклеотиды конкурируют в реакции продолжения цепи с обычными нуклеотидами, в результате они встраиваются в растущую цепь в различных местах и в итоге получается смесь из комплементарных цепей различной длины, которая разделяется электрофорезом на ПААГ и регистрируется авторадиографом.
Метод позволяет определять последовательность нуклеотидов в цепях до 400 мономеров, в то время как по Максаму-Гилберту только 250.
Экспрессия векторов в эукариотических клетках
Многие генетические заболевания у млекопитающих связаны с отсутствием или дефектами внутриклеточных белков, вызванные дефектами генов, кодирующих эти белки. Лечение таких заболеваний возможно с использованием рекомбинантных технологий, с применением специально сконструированных кольцевых ДНК (векторов), содержащих НОРМАЛЬНЫЕ гены, отсутствующие в организме. К настоящему моменту времени созданы многочисленные векторы для этих целей, способные экспрессировать в клетках млекопитающих in vitro. Однако, подобные векторы, применяемые in vivo, должны быть селективны по отношению к тканям с дефектными клетками. Непосредственное генетическое модифицирование в организме насчитывает слишком мало примеров успешного применения.
Определенные типы разработанных векторов позволяют репликацию, транскрипцию и трансляцию чужеродных генов, осуществляемую на клеточных культурах, выращиваемых in vitro, включая ДНК- и РНК- вирусные векторы, содержащие вставки целевой ДНК. Эти вирусные векторы способны инфицировать и реплицировать в клетке-хозяине. Экспериментально сконструированные векторы позволяют экспрессию чужеродных генов только, если содержат существенные элементы ДНК. Обычно эти элементы привносятся непосредственно с вирусной ДНК.
Так называемые челночные векторы, содержат сигналы репликации, необходимые в бактериальных системах и системах млекопитающих, поэтому могут применяться для производства белков в обоих типах клеток. Челночные векторы могут быть клонированы и очищены из бактериальных клеток в больших количествах, а затем перенесены для экспрессии в клетки млекопитающих. Некоторые из них способны внедряться в геном клетки-хозяина, другие- остаются внехромосомальными (эписомальными), сохраняя, однако стабильную возможность экспрессии заложенного в них интересуемого гена, Некоторые из последних- кочуя в дочерние клетки при их делении, другие- работая только в период жизни клетки.
Процесс переноса информации чужеродной ДНК в эукариоту в виде вектора называется трансфекцией. Подобный процесс переноса информации в клетки прокариот называют трансформацией. Наиболее часто используемый метод трансфекции включает образование комплекса ДНК с фосфатом кальция или DEAE-декстраном, которые затем захватываются клеткой в результате эндоцитоза. ДНК затем переносится из цитоплазмы в ядро, где и происходит ее репликация и экспрессия. Детали механизма трансфекции неизвестны. Обычно трансфекции подвергаются 10-20 % клеток культуры.
Экспрессия рекомбинантных генов в клетках млекопитающих требует присутствия в векторе ДНК-контролирующих элементов, которые необязательны в бактериальных системах. Для экспрессии в эукариотической клетке, ген должен быть вставлен в вектор в нужном направлении относительно контролирующих элементов, включающих промотер, сигналы полиаденилирования, в некоторых случаях- интроны. Некоторые или все из этих элементов могут оказаться в векторе, если использовалась цельная геномная ДНК при клонировании. Если же клонировали только часть ДНК, они могут отсутствовать, поскольку были удалены при обработке рестриктазами. В таких случаях они должны присутствовать в самом векторе.
Популяция эукариотических клеток, подвергшихся трансфекции, должна быть обнаруживаема с целью их направленного выращивания, ведь их относительное число не превышает 10-20 %. Конструирование векторов, содержащих экспрессируемый ген и маркер одновременно, чрезвычайно сложно, поэтому прибегают к котрансфекции, когда в клетку вносят одновременно два вектора, с геном и маркером. В большинстве случаев, не менее 90 % преобразованных клеток содержат оба вектора.
Два из наиболее широко применяемых маркера- гены тимидинкиназы (тк) и дигидрофолат-редуктазы (дгфр). Продукт тк-гена – тимидинкиназа образуется в большинстве клеток млекопитающих и участвует в путях метаболизма тимидина. Некоторые мутантные линии клеток не содержат функционального гена тимидинкиназы (тк-) и такие клетки не выживают в средах, содержащих гипоксантин, аминоптерин и тимидин. Только те из (тк-)-мутантных клеток, которые в результате котрансфекции получат вектор, несущий нормальный ген, способны к росту. Они и подвергаются процедуре внедрения интересуемого генома.
Ген дегидрофолат-редуктазы (дгфр) необходим для поддержания в клетке нормального уровня активности дегидрофолат-редуктазы, необходимой в биосинтезе нуклеотидов. Клетки, не содержащие этого фермента, выживают только в средах, содержащих тимидин, глицин и пуриновые азотистые основания. Если провести трансфекцию мутантных клеток одновременно двумя векторами (с интересуемым геном и геном дгфр), то становится возможным их определение от нетрансфектированных клеток при выращивании на средах, не содержащих перечисленные выше компоненты.
Другой подход для определения немутировавших клеток- использование для котрансфекции бактериального гена, кодирующего аминогликозид-3’-фосфотрансферазу (АФТ). Клетки, экспрессирующие ген АФТ, устойчивы к аминогликозидным антибиотикам типа неомицина и канамицина, ингибирующих синтез протеинов как у прокариот, так и у эукариот. Поэтому векторы, несущие ген АФТ, могут применяться как на бактериальных клетках, так и на клетках млекопитающих.
Дата публикования: 2015-07-22; Прочитано: 656 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
