 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Стандартные окислительно-восстановительные потенциалы
|
|
Первое слагаемое в правой части уравнения Нернста
φ(Ox/Red) = φo(Ox/Red) + RT /(nF) ln [Ox]/[Red],
– это стандартный окислительно-восстановительный потенциал, т.е. потенциал, измеренный или чаще вычисленный при стандартных условиях. В стандартных условиях концентрации всех частиц в растворе по определению равны 1 моль/л, и второе слагаемое в правой части уравнения обращается в нуль. В нестандартных условиях, когда хотя бы одна из концентраций не равна 1 моль/л, определяемый уравнением Нернста потенциал отличается от стандартного. Потенциал в нестандартных условиях часто называют реальным потенциалом. Термином «электрохимический потенциал», строго говоря, пользоваться не рекомендуется, так как он закреплен за другой величиной (суммой химического потенциала иона и произведением его заряда на электрический потенциал), с которой студенты встретятся в курсе физической химии.
Если в ОВР принимают участие один или несколько газов, их стандартными состояниями являются состояния при давлении 1 атм = 101300 Па. Температура при определении стандартных состояний и стандартных потенциалов не стандартизуется и может быть любой, но таблицы стандартных потенциалов в справочниках составлены для Т =298 К (25 оС).
Необходимо отличать стандартные состояния веществ от не имеющих с ними по существу ничего общего нормальных условий (р = 1 атм, Т =273 К), к которым, пользуясь уравнением состояния идеальных газов pV = nRT, принято приводить объемы газов, измеренные в иных условиях.
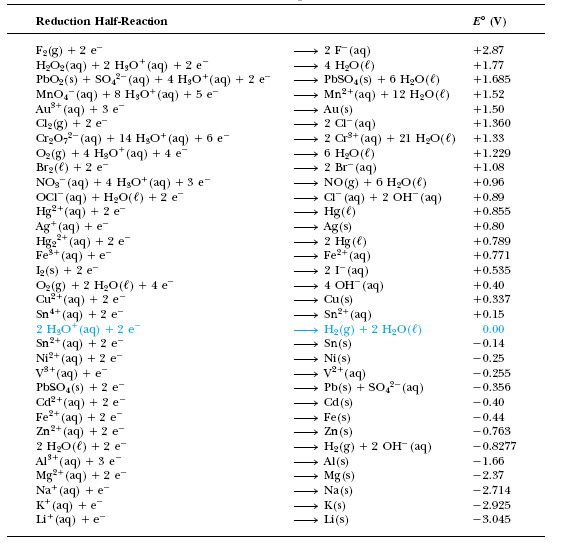
Таблица стандартных потенциалов, составленная в порядке их убывания, однозначно ранжирует окислители (т.е. окисленные формы различных окислительно-восстановительных пар) по их силе. Одновременно ранжируются по силе и восстановители (восстановленные формы пар).
В природной воде значение потенциала колеблется от – 0,40 до + 0,70 В, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
Окислительная:
Характеризуется значениями Еh > + (100 - 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Ситуация, наиболее часто встречающаяся в поверхностных водах.
Переходная окислительно-восстановительная:
Определяется величинами Еh от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов.
Восстановительная:
Характеризуется значениями Еh < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород.
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды.
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. В частности, при обслуживании бассейнов, используется таблица зависимости продолжительности жизни типичных микроорганизмов (E-Coli) от величины редокс-потенциала.
Дата публикования: 2015-07-22; Прочитано: 6643 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
