 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Система захисту. По сигналу «В схему захисту» - відкривається магістраль Gп, відключається подача теплоносія і відбір концентрованого розчину
|
|
По сигналу «В схему захисту» - відкривається магістраль Gп, відключається подача теплоносія і відбір концентрованого розчину.
Лекція 10. Загальна характеристика масаобмінних процесів.
10.1.Вид діаграми рівноваги для системи з 3 ступенями свободи c1* =f(c2) при
θ=const й P=const.
10.2.Вид діаграми рівноваги для системи з 2 ступенями свободи
c1* =f(c2) при Р=const.
10.3. Рівняння робочої лінії масопередачі при протитечії речовин, що розподіляють.
10.4. Вид робочої лінії при протитечії речовин, що розподіляють.
10.5. Рівняння робочої лінії процесу при прямотоку речовин, що розподіляють.
10.5. Рівняння робочої лінії процесу при прямотоку речовин, що розподіляють.
10.6. Вид робочої лінії при прямотоку речовин, що розподіляють.
10.7. Діаграма с1- с2 при розташуванні робочої лінії вище рівноважної.
10.8. Діаграма с1-с2 при розташуванні робочої лінії нижче рівноважної.
10.9. Середня рушійна сила процесів масопередачі.
10.10. Основне рівняння масопередачі.
10.1.Вид діаграми рівноваги для системи з 3 ступенями свободи
c1* =f(c2) при θ=const й P=const;

Рис.1.
На діаграмі позначено:
· c1 - концентрація компонента в газовій фазі, cy.
· c2 - концентрація компонента в рідкій фазі, cх.
· при cх =c2, рівноважне значення концентрації в газовій фазі буде cy* = c1*.
10.2.Вид діаграми рівноваги для системи з 2 ступенями свободи
c1* =f(c2) при Р=const.

Рис.2.
· Кожна крапка кривої мал.2 відповідає рівноважному стану при різних температурах.
· Відношення концентрацій фаз при рівновазі називають коефіцієнтом розподілу:
 (1)
(1)
· Графічно m можна визначити:  ,
,
тангенс кута нахилу дотичній до лінії рівноваги, якщо вона нелінійна,
або як тангенс кута нахилу самої лінії рівноваги, якщо вона лінійна.
10.3. Рівняння робочої лінії масопередачі
при протитечії речовин, що розподіляють.
Схема руху речовин, що розподіляються
противотоком:
 G1 c1
G1 c1
с 1н с 1к
с 2к с 2н
G2 c2
Рис.3.
Матеріальний баланс процесу по цільовому компоненті можна записати у вигляді:
 (1)
(1)
або
 (2)
(2)
Для довільного перетину апарата з концентраціями с1 і с2 можна записати:
 (3а)
(3а)
або
 (3б)
(3б)
Виразимо з (3б) залежність с1 = f(с2):
 (4)
(4)
· Вираз (4) - рівняння робочої лінії (робітників концентрацій) масопередачі.
· Це рівняння прямої с 
· Робоча лінія всього апарата обмежена крапками з координатами с1н , с1к , с2н , с2н .
10.4. Вид робочої лінії при протитечії речовин, що розподіляють.

Рис.4.
10.5. Рівняння робочої лінії процесу при прямотоку речовин, що
розподіляють.
Схема руху речовин, що розподіляються
прямотоком:
 G1 c1
G1 c1
с 1н с 1к
с 2н с 2к
G2 c2
Рис.5.
Матеріальний баланс процесу по цільовому компоненті можна записати у вигляді:
 (5)
(5)
або
 (6) Для довільного перетину апарата з концентраціями с1 і с2 можна записати:
(6) Для довільного перетину апарата з концентраціями с1 і с2 можна записати:
 (7а)
(7а)
або
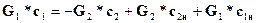 (7б)
(7б)
Виразимо з (7б) залежність с1 = f(с2):
 (8)
(8)
· Вираз (8) - рівняння робочої лінії (робочих концентрацій масопередачі) при прямотоку речовин, що розподіляють.
· Це рівняння прямої с 
· Робоча лінія всього апарата обмежена точками з координатами с1н , с1к , с2н , с2н .
10. 6. Вид робочої лінії при прямотоку речовин, що розподіляють.

Рис.6.
10. 7. Діаграма с1- с2 при розташуванні робочої лінії
вище рівноважної.

Рис.7.
· З діаграми мал.7 треба:

· Це означає, що цільовий компонент буде переходити з фази G1 у фазу G2.
10. 8. Діаграма с1-с2 при розташуванні робочої лінії
нижче рівноважної.

Рис.8
· З діаграми мал.8. треба:

· Це означає, що цільовий компонент буде переходити з фази G2 у фазу G1.
10.9. Середня рушійна сила процесів масопередачі.
· при  :
:
 (1)
(1)
· при  :
:
 (2)
(2)
10.10. Основне рівняння масопередачі.
 (1)
(1)
де М - маса стерпної речовини, кг/с;
К - коефіцієнт масопередачі, 
∆ср - середня рушійна сила процесу масопередачі.
· Визначення рушійної сили по кожнійій з фаз:
 (2)
(2)
 (3)
(3)
де
∆срy і ∆срx - середні рушійні сили, у фазах y й x;
Ky і Kx - коефіцієнти масопередачі для фаз y й x.
Лекція 11. Автоматизація процесу кристалізації.
11.1. Система з різким зростанням розчинності.
11.2. Система із плавною зміною розчинності.
11.3. Система з незначною зміною розчинності.
11.4. Кінетика процесу кристалізації.
11.4.1. Швидкість утворення центрів кристалізації.
11.4.2. Якісна характеристика швидкості росту кристалів.
11.4.3. Кількісна оцінка швидкості росту кристалів на підставі дифузійної теорії.
11.5. Об'єкт управління.
11.5.1. Ізогідричний кристалізатор безперервної дії з мішалкою.
11.5.2.Матеріальний баланс по всій речовині
11.5.3. Матеріальний баланс по кристалізуємої речовині.
11.6.Математичний опис для розміру часток.
11.7.Тепловий баланс процесу кристалізації.
11.8.Інформаційна схема кристалізатора.
11.9.Типова схема автоматизації процесу кристалізації.
11.1. Система з різким зростанням розчинності.

Рис.1.
1 - c*=f(q) - крива розчинності, що характеризує рівновагу концентрованого розчину при зміні q.
2 - сп= f(q) - лінія умовної границі метастабільної області.
А - нестійка, лабільна область масового утворення центрів кристалізації;
Б - відносно стійка метастабільна галузь освіти й розчинення кристалів;
У - область ненасичених розчинів.
11.2. Система із плавною зміною розчинності.

Рис.2.
· Перехід в область пересичених розчинів відбувається тільки при значному охолодженні.
· При цьому виділяється незначна кількість твердої фази.
· Спосіб кристалізації, що рекомендує - одержання сп видаленням частини розчинника з розчину.
· Рекомендуемый метод кристалізації - вакуум-кристалізація.
11.3. Система з незначною зміною
розчинності.

Рис.3.
· Спосіб кристалізації, що рекомендує - одержання сп шляхом випарювання розчинника з розчину.
· Рекомендуемий метод кристалізації - ізотермічна кристалізація.
· Ізотермічна кристалізація - це кристалізація з видаленням частини розчинника випаром або виморожувановим.
11.4. Кінетика процесу кристалізації.
11.4.1. Швидкість утворення центрів кристалізації:
 ,
,
де
 - число часток, що утворяться в одиниці об'єму в одиницю часу;
- число часток, що утворяться в одиниці об'єму в одиницю часу;

КN, КN0 - константи,  ,
,
EN - енергія активації зародкоутворення, (кдж/кг);
Сп і З* - концентрації пересиченого й насиченого розчинів, (кг/м3);
m=2 - 4 - кінетичний коефіцієнт, що залежить від типу речовини, що кристалізується.
11.4.2. Якісна характеристика швидкості росту кристалів.
Залежності швидкості кристалізації від часу.
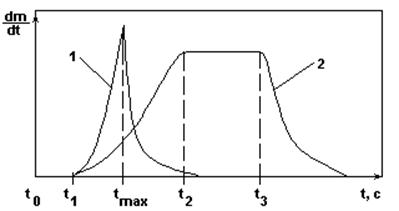
Рис.4.
1 - 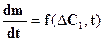 ;
;
2 -  ;
;  .
.
t0 - t1 - індукційний період, тобто період рухливої рівноваги зародків з розчином.
Крива 1 - при великому ступені пересичення має різкий максимум швидкості процесу в момент tmax.
Крива 2 - при малому ступені пересичення має пологий максимум протягом часу t2 - t3.
11.4.3. Кількісна оцінка швидкості росту кристалів на підставі дифузійної теорії.
· Процес вбудовування молекул у кристали йде з великою швидкістю й кінетика процесу визначається швидкістю підведення речовини до поверхні кристала:
 (1)
(1)
де
b - коефіцієнт массоотдачи, кг/м2*с;
Сп-С*=D, (кг/кг);
F - поверхня кристала, (м2).
Для апаратів з мішалками коефіцієнт массоотдачи b (залежить від наступних параметрів:
 ,
,
де
а - характеристичний розмір кристала;
n - число оборотів мішалки, про/хв;
dм - діаметр мішалки, м.
· Процес підведення речовини до поверхні кристала йде з великою швидкістю. Кінетика процесу визначається швидкістю вбудовування молекул у кристал:
 (2)
(2)
де
КB - константа швидкості вбудовування молекул у кристал;
n - емпірична постійна.
· Обидва процеси протікають із порівнянними швидкостями:
 (3)
(3)
де
К - загальний коефіцієнт швидкості процесу, обумовлений зі співвідношення:
 .
.
З огляду на, що К=f(b, KB), а b=f(n), у цілому можна вважати:
 .
.
Таким чином, швидкість росту кристалів визначається поверхнею кристала, рушійною силою процесу й швидкістю мішалки.
11.5. Об'єкт управління.
11.5.1. Ізогідричний кристалізатор безперервної дії з мішалкою.

Рис.5.
У схемі прийнято:
Gс=Gмр+Gкр; qмр = qкр = qз =q;
Скр = 1, тобто кристали чисті.
Робота об'єкта
Вихідний гарячий насичений розчин подається зверху в апарат, де прохолоджується за допомогою холодоносія, що подається в сорочку й стає пересиченим.
У результаті пересичення розчину й при інтенсивному перемішуванні відбувається кристалізація цільового компонента з розчину з утворенням кристалів (Мкр®Gкр).
При цьому концентрація розчину знижується й рідка фаза, що залишилася, Gмр у суміші з Gкр у вигляді потоку суспензії Gc виводиться із процесу.
Показник ефективності процесу - діаметр кристалів, dкр.
Ціль керуванняпроцесом - забезпечення dкр = dкрзд.
11.5.2.Матеріальний баланс по всій речовині
Рівняння динаміки:
 (1)
(1)
Рівняння статики при  :
:
 (2)
(2)
11.5.3. Матеріальний баланс по кристалізуємої речовині.
Рівняння динаміки:
 (3)
(3)
Рівняння статики при  :
:
 (4)
(4)
· У рівняння (4) підставимо вираз  з (2) і думаємо Скр=1:
з (2) і думаємо Скр=1:
 (5)
(5)
· З (5) виразимо Gкр у явному виді:
 (6)
(6)
· Вираження (6) представляє Gкр на основі матеріального балансу процесу кристалізації.
· Але  , що визначається на основі фізики процесу массопередачи:
, що визначається на основі фізики процесу массопередачи:
 (7)
(7)
де
 - число кристалів, що утвориться
- число кристалів, що утвориться
за час tін в об'ємі Vс;
 - зміна маси одного кристала в од. часу, кг/с.
- зміна маси одного кристала в од. часу, кг/с.
· Тому що  й
й  , а також
, а також  , те на основі фізики массопередачи можна вважати:
, те на основі фізики массопередачи можна вважати:
 .
.
· У цілому, на підставі (6) і (7) можна записати:
 .
.
11.6.Математичний опис для розміру часток.
· На підставі дифузійної теорії й правила Мак-Бена швидкість росту кристалів можна представити через радіус часток:
 (9)
(9)
де
 (10)
(10)
r - радіус кристала, м; t - час, с;
К, К0 - константи,  ;
;
Сп, С* - концентрації пересиченого й насиченого розчинів, кг/м3;
Еа - енергія активації, кдж/кг;
q - температура, К;
R - універсальна газова постійна, кдж/кг*К.
· На підставі (9) і (10) - діаметр кристала можна представити:
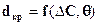 .
.
· Якщо процес кристалізації вести при q = const = qзд і забезпечити Сн= const, то Сп і С* будуть визначені, тому що система має 2 ступеня свободи (s=2).
· Таким чином, dкр=dкрзд можна забезпечити стабілізацією q за умови Сн= const.
11.7. Тепловий баланс процесу кристалізації.
Рівняння динаміки:
 (11)
(11)
Можна прийняти q = qмр = qкр = qс.
Рівняння статики при  :
:
 (12)
(12)
· На підставі (11) і (12) можна вважати:

· Кращий керуючий вплив Gхл.
11.8.Інформаційна схема кристалізатора.

Рис.6.
· Основні регульовані змінні:  ;
;
· Можливі регулюючі впливи: 
· Можливі контрольовані збурювання: 
· Можливі неконтрольовані збурювання:
 .
.
· У цілому, кристалізатор є складним багатозв'язним об'єктом.
11.9.Типова схема автоматизації процесу кристалізації.

Рис.7.
Дата публикования: 2014-10-23; Прочитано: 565 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
