 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
ГЛАВА 3. 3.1. Общая характеристика химического равновесия
|
|
 |
3.1. Общая характеристика химического равновесия. Константа химического равновесия
Большинство химических реакций, использующихся в аналитической химии, можно считать обратимыми. Протекание обратимой химической реакции в закрытой системе приводит к установлению химического равновесия.

Все химические равновесия характеризуются соответствующими константами химического равновесия. Выражение для константы химического равновесия можно получить, используя термодинамический или кинетический подход. Рассмотрим вначале идеальный случай, когда химическая реакция протекает в идеальном растворе - гипотетической системе, в которой взаимодействия между всеми компонентами одинаковы и не зависят от природы частиц. Пусть имеется следующее химическое равновесие
aA + bB › cC + dD

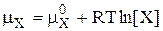
В состоянии равновесия  , следовательно
, следовательно
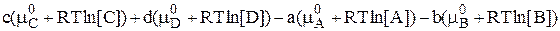 = 0
= 0


Так как  , находящаяся в левой части полученного уравнения, является постоянной величиной, то и произведение, стоящее в правой части этого уравнения - также постоянная величина.
, находящаяся в левой части полученного уравнения, является постоянной величиной, то и произведение, стоящее в правой части этого уравнения - также постоянная величина.
Отношение произведения концентраций находящихся в состоянии равновесия продуктов химической реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к соответствующему произведению равновесных концентраций реагирующих веществ называется константой химического равновесия (К)

Дата публикования: 2014-10-19; Прочитано: 815 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
