 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Изменение энергии реагирующей системы при некаталитической (1) и каталитической (2) реакции
|
|
Е – энергия активации некаталитической реакции;
Екат – каталитической реакции;
е1 и е2 – энергии активации промежуточных стадий.
проходящей в отсутствии катализатора по схеме:
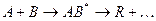
через образование активного комплекса АВ*. В присутствии катализатора реакция идет по другому пути через несколько элементарных стадий:
А + [kat] = A[kat]
A[kat] + B = AB*[kat]
AB*[kat] = R + [kat]...
Поскольку катализаторы не ускоряют диффузионные процессы, их можно применять лишь для процессов которые идут в кинетической области.
Перемешивание – увеличивает константу скорости процесса вследствие замены молекулярной диффузии на конвективную, т.е. снижение диффузионных сопротивлений, которые препятствуют взаимодействию компонентов. Итак, усиливать перемешивание нужно до тех пор, пока процесс из диффузионной области не перейдет в кинетическую.
В гомогенных процессах перемешивания выравнивает концентрацию в реакционном объеме, усиливает и увеличивает число столкновений реагирующих молекул. В гетерогенных системах перемешивание заменяет медленную молекулярную диффузию, которой определяется суммарная скорость процесса, на более быструю конвективную. Кроме того, перемешивание увеличивает поверхность взаимодействующих фаз, вследствие чего ускоряется перенос реагирующих компонентов и ускоряется реакция.
Увеличение движущей силы процесса может достигаться:
1. Увеличением концентрации взаимодействующих компонентов в исходных материалах (сырье).
2. Увеличение давления.
3. Отводом продуктов реакции из реакционного объема.
4. Сдвигом равновесия при изменении температуры и давления.
1. Увеличении концентрации взаимодействующих компонентов в исходном сырье повышает С и пропорционально скорость процесса. Способ увеличения концентрации взаимодействующих компонентов в исходном сырье зависит от агрегатного состояния материала. Увеличение содержания полезного составляющего в твердом сырье – называется обогащением, а в жидким и газообразном – концентрированием.
2. Повышение давления – влияет на скорость процесса (скорость достижения равновесного состояния обратимых процессов) и состояние равновесия.
Эффективность повышения давления зависит от агрегатного состояния реагирующих веществ.
Наиболее сильно давление влияет на процессы, которые идут в газовой фазе или же при взаимодействии газов с жидкостями твердыми телами. В меньшей степени давление сказывается на процессах идущих в жидкой или твердой фазах.
Повышение давления уменьшает объем газовой фазы и соответственно увеличивает концентрации взаимодействующих веществ. Таким образом, повышение давления это то же самое, что и увеличение концентрации реагентов.
Влияние давления определяется кинетическими уравнениями.

где 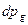 - парциальное давление компонента в газовой фазе.
- парциальное давление компонента в газовой фазе.
 - движущая сила процесса.
- движущая сила процесса.
Для реакции:

если она необратимая или протекает вдали от состояния равновесия.

Парциальные давления каждого компонента пропорциональны общему давлению Р. При общем давлении смеси Р и доле в ней компонентов А и В m и n соответственно парциальные давления их:

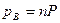

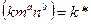
Уравнение скорости процесса:

a+b=n - порядок реакции.
Итак, скорость газовой реакции пропорциональная общему давлению смеси в степени, равной порядку реакции.
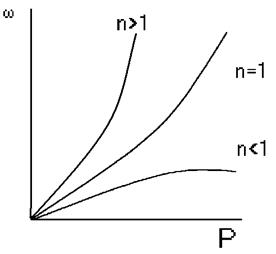
Рис. 14 Влияние давления на скорость газовых реакций разного порядка
Для гетерогенных процессов адсорбции, абсорбции концентраций и других процессов перехода газового компонента в твердую или жидкую фазу:
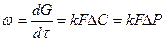
Если процесс обратим и далек от равновесия то:

Где  - действительная концентрация компонента в газовой фазе, итак, порядок реакции n=1 и преобразовав формулу:
- действительная концентрация компонента в газовой фазе, итак, порядок реакции n=1 и преобразовав формулу:
 получим
получим 
т.е. скорость этих процессов прямо пропорциональная давлению. Поэтому в промышленности широко применяют повышение давления для ускорения абсорбции и увеличения концентрации компонента в жидкости соответственно закону распределения.
Для обратимых газовых реакций, которые протекают вблизи от состояния равновесия, движущая сила реакции выразится формулой:

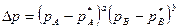
Зависимость от давления константы равновесия выраженной в молярных частицах определяют по уравнению:

где 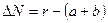
Формула ΔN- выражает количественно принцип Ле -Шателье, с увеличением давления Р для реакций, которые идут с уменьшением объема (ΔN-величина отрицательная) константа равновесия увеличивается, а равновесные концентрации исходных компонентов уменьшаются (рА* и рв*).
Для обратимых газовых реакций, которые идут с увеличением объема, давление сказывается положительно вдали от состояния равновесия за счет роста действительных концентраций исходных реагентов рА и рВ. Однако при приближении к состоянию равновесия выход продукта проходит через максимум, а потом снижается.
Это вызвано уменьшением КN и соответствующим увеличением равновесных концентраций исходных компонентов (рА* и рв*) в формуле:
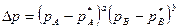

Рис. 8 Зависимость выхода продукта от давления для обратимой газовой реакции
τ, t, СА, и СВ = сonst
1- ΔN< 0 2 - ΔN> 0
Дата публикования: 2014-11-18; Прочитано: 462 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
