 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Физико-химические основы химической технологии
|
|
Для того чтобы достичь высокой продуктивности производства, надо овладеть методами влияния на основные факторы, которые характеризуют рациональное ведение химико-технологических процессов — равновесие и скорость химических процессов.
3.1. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССАХ
В основе любого химико-технологического процесса лежит - химическая реакция.
С теоретической точки зрения все реакции обратимы, т.е. могут протекать как в прямом, так и в обратном направлении. Однако во многих случаях равновесие смещено в сторону продуктов реакции и обратная реакция практически не протекает. Поэтому технологические процессы делят на обратимые и необратимые. Необратимые процессы протекают лишь в одном направлении.
Все обратимые химико-технологические процессы стремятся достичь равновесия, т.е. такого состояния, когда скорости прямого и обратного процессов становятся одинаковыми. Вследствие этого соотношения концентраций компонентов в системе будут неизменными до тех пор, пока не изменятся внешние условия. Из условий, которые влияют на состояние равновесия, наибольшее практическое значение имеют изменение концентрации, температуры и давления. При изменении этих параметров равновесие меняется и в системе самопроизвольно происходят диффузионные и химические процессы, которые ведут к установлению равновесия в новых условиях. В соответствии со вторым законом термодинамики одним из условий химического равновесия в изолированной системе есть максимум энтропии S. Дальнейший прирост энтропии, обязательный для всех самопроизвольных процессов в состоянии равновесия, не происходит, т.е. dS=0.
Второй закон термодинамики дает возможность определить направление, в котором при данных условиях может самопроизвольно проходить взаимодействие в исследованной системе, а также границы такого (самопроизвольного) протекания процесса, т.е. состояние равновесия. Отсюда можно определить возможный выход нужного продукта в определенных условиях. На основе второго закона термодинамики можно установить, как изменение внешних условий (температуры, давления и т.п.) влияет на состояние равновесия и, итак, что особенно важно для практики, какими должны быть эти внешние условия, чтобы этот процесс мог проходить самопроизвольно в нужном направлении с оптимальными результатами.
Качественно влияние основных параметров технологичного режима на равновесие в гомогенных и гетерогенных системах определяется принципом Ле Шателье, в соответствии с которым в системе, выведенной из состояния равновесия, происходят изменения, направленные на уменьшение действия выводящую систему из равновесия.
Для примера рассмотрим применение принципа Ле Шателье к экзотермической реакции синтеза, которая лежит в основе многих промышленных процессов
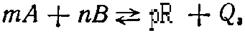 (13)
(13)
Где m, п, р — количество молей вещества А, В,R; Q — тепловой эффект.
Если вещества газообразные, то m, п, р заменяют на V (объем веществ). Если реакция проходит с уменьшением объема, то V А+ V В> V R .
Важнейшие факторы, которые влияют на количество получаемого продукта, такие: температура t, давление Р, концентрация (соотношения в реакционном объеме) реагирующих компонентов СА, СВ, СR.Для смещения равновесия вправо, т.е. увеличения выхода продукта (увеличения равновесного выхода) по принципу Ле Шателье нужно снижать температуру концентрацию СR,т.е. выводить продукт из сферы реакции, а также увеличивать давление. р и количество исходных веществ САи СВ, (если реагируют газы). При повышении САстановится более полным превращение вещества В, и, наоборот, увеличение Свспособствует более полному превращению вещества А. эти закономерности часто используют в промышленности.
Количественно равновесие процессов измеряется константой равновесия. В физической химии константа равновесия определяется как величина термодинамическая, но её можно рассчитать также по закону действующих масс, в соответствии с которым скорость химической реакции в данный момент прямо пропорциональна произведению молярных концентраций реагирующих веществ. Для определения условий гомогенных реакций надо знать константы равновесия и начальные концентрации реагирующих веществ. Если реакция проходит в гетерогенной системе, состоящей из газообразных и твердых (или жидких) веществ, то равновесие фактически определяется лишь концентрацией газов. Законом действующих масс и уравнением изотермы реакции в технологии широко пользуются для определения выходов продуктов процесса, для выяснения, в каком направлении и в какой, области проходит реакция при заданном количественном составе исходной реагирующей смеси. Поскольку закон действующих масс иуравнение изотермы основаны на уравнении Менделеева — Клапейрона (р= nRT ), то он справедлив только для идеальных газов и беспредельно разбавленных растворов, а практически— для разреженных газов иразбавленных растворов. В реальных газах (сжатых), в уравнение константы равновесия вместо парциальных давлений надо подставлять величины летучести (фугитивности) реагирующих веществ, а для концентрированных растворов — концентрации активностями. Закон действующих масс можно рассматривать как математическую модель химического равновесия.
Константу равновесия К вычисляют как отношение константы скорости прямой и обратной реакции в равновесном состоянии
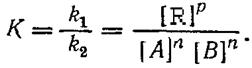 (14)
(14)
Чтобы получить безразмерные значения К, в формулы подставляют относительные величины, например отношение действительных парциальных давлений к стандартным.
Для растворов пользуются мольными концентрациями или концентрациями ионов. Значение констант равновесия К для разных реакций, определены опытным путем или рассчитаны аналитически в зависимости от температуры и давления, и приведены в специальных справочниках.
При изменении таких технологических параметров как температура, давление, концентрация реагирующих веществ равновесие изменяется, и процесс может протекать в том или другом направления вновь до наступления равновесия.
Количественно состояние равновесия описывается законом действующих масс (ЗДМ): При постоянной температуре и давлении и наличии равновесия, отношения произведения действующих масс продуктов реакции к произведению действующих масс исходных веществ есть величина постоянной, называемой константой равновесия К.
При вычислении к можно применять число молей Nі, концентрацию Сі или парциальные давления компонентов pі. Соответственно получают КN, КС, КР.
Рассмотрим выражение для констант равновесия на примере реакций синтеза:

Эта реакция является основой для многих промышленных процессов. Поэтому ее можно рассматривать как модельную для таких процессов как окисление SO2, абсорбция многих газов водой синтез NH3 и HCl, получение спиртов и высокомолекулярных соединений.
Здесь a,b,r - стехиометрические коэффициенты, ∆H - тепловой эффект реакции при постоянном давлении.
Если за действующие массы принять моли,

Если за действующие массы принять концентрацию,
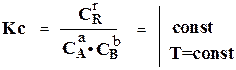
Если вещества А, В, R- газы,
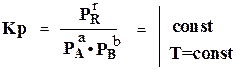
Константы равновесия КN, КС и Кр связанные между собой уравнениями
KP = KC (RT)∆n
KC = KN P∆n
(Pі = Cі RT уравнение Менделеева- Клапейрона)
где Р - общее давление газовой смеси
∆n - увеличение числа молей газов вследствие реакции
Для нашей реакции:
∆n = r - (a + в)
Если в реакции применяется большой избыток одного из реагирующих веществ, например концентрация воды при гидролизе или парциальное давление кислорода при обжиге на воздухе то концентрацию (парциальное давление) этого избыточного компонента можно считать постоянной, тогда выражение для константы равновесия для нашей (модельной) реакции при избытке компонента В будет иметь вид:
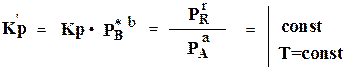
Аналогичные соображения справедливые и для гетерогенного равновесия. В гетерогенных системах обратимыми называют такие процессы, в которых возможен самопроизвольный переход вещества или энергии из одной фазы в другую в обеих направлениях.
Как правило, все гетерогенные взаимодействия происходят на поверхности раздела фаз. Поэтому, до тех пор, пока существует, например, твердая фаза в каком то гетерогенном преобразовании, концентрация ее поверхности остается практически постоянной и в виде некоторого исправления входит в константу равновесия.
Например, для реакции:
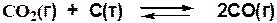
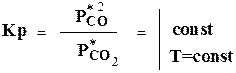
Уравнение:
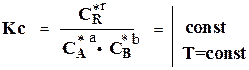
не применяется в технических расчетах, так как равновесные концентрации обычно не известные и определяются при известных исходных концентрациях по величине К.
Для большого количества химических преобразований константы равновесия при стандартных условиях приведенные в справочниках физико-химических величин в виде таблиц и номограмм.
Для определения к по опытным данным ее выражают через выход продукта.
Выходом продукта – называется отношение количества фактически полученного продукта Gф к максимальному количеству продукта Gм, которое могло бы получится из данного исходного вещества:
X = Gф / Gм
Для химических реакций максимальное количество продукта является стехиометрическим, т.е. определяется по уравнению реакции с учетом количества того исходного вещества, которое имеется в недостатке.
Выход продукта относительно химических реакций называют еще степенью превращения, а в процессах массопередачи — степенью межфазового перехода.Степень превращения или межфазного перехода, можно выразить отношением количества израсходованного вещества к общему его количеству в начале процесса G0
Выход продукта выражают в зависимости от условий - степенью превращения, равновесной и фактическим выходом.
Если в формулу Х =Gф/ Gм вместо Gф подставить Gp – равновесное количество продукта, полученное в момент равновесия. То выход продукта будет называться равновесным: Хр =Gф/ Gр
Для необратимых процессов Хр =1 такой выход обычно называют теоретическим и обозначают Хт.
Для обратимых процессов равновесный выход, который совпадает с равновесной степенью превращения всегда меньше единицы (Хр< 1) так как равновесие наступает при неполном превращении исходных веществ в продукты реакции.
Обычно равновесный выход определяют по известной константе равновесия, с которой он связан в каждом конкретном случае определенным соотношением. С другой стороны значения к, приведенные в таблицах, вычислены по тем же формулам через равновесный выход продукта, который определяется экспериментально. Для оценки влияния концентрации на выход удобнее пользоваться так называемым выходом от теоретического или фактическим выходом Хф, что более всего точно характеризует обратимый технологический процесс, будучи мерой его скорости.
Фактическим выходом называется отношение полученного продукта Gф к количеству его, которое получилось бы в состоянии равновесия Gp .
Выход выражают в долях единицы или в %:
Хф = Gф / Gp × 100 или (Gф / Gм Хр) × 100
Рассмотрим связь константы равновесия Кр и равновесной степени превращения Хр для газовой реакции:
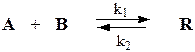
По такому типу протекает, например синтез фосгена


После установления равновесия на один моль введенного вещества реакционная смесь будет содержать
(1- ХА*) – молей реагента А
(1- ХА*) -молей реагента В
и ХА* молей продукта R
Всего в равновесной смеси будет находиться:
(1- ХА*) + (1-ХА*) + ХА* =(2- ХА*)
Если общее давление в системе в момент равновесия P, то равновесные парциальные давления:


Тогда связь между константой равновесия и равновесной степенью превращения выразится уравнением:

Для реакций типа 
Например, синтез хлористого водорода
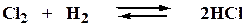
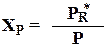 Так как
Так как 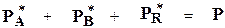
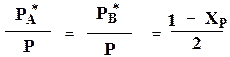

Из уравнений видно, что для первой реакции, которая идет с уменьшением объема и соответствия с принципом Ле-Шателье равновесная степень превращения увеличивается с повышением давления, во втором случае выход не зависит от давления.
Таким образом, можно вывести уравнения, которые связывают х и к для любой обратимой реакции.
Зависимость константы равновесия реакции от температуры определяется обычно уравнениями изохоры и изобары Вант-Гоффа, что даёт возможность определить тепловой эффект реакции и нужную для осуществления реакции температуру. Ими широко пользуются при расчетах химических равновесий.
Уравнение изохоры и изобары показывают соотношения константы равновесия, температуры и теплового эффекта химической реакции при объеме (изохора) и давлении (изобара).
Для газовых реакций, если можно применить законы идеальных газов, а также для реакций в разбавленных растворах константу равновесия К выражают через концентрации, которые принимают участие в реакции. В этом случае уравнение изохоры реакции будет иметь такой вид:
 (15)
(15)
где  V— тепловой эффект реакции, которая протекает при постоянном объеме (
V— тепловой эффект реакции, которая протекает при постоянном объеме ( Vбудет положительным, если во время реакции теплота выделяется); Т — абсолютная температура, К; R— газовая постоянная, равная 8,32 Дж/ (моль К).
Vбудет положительным, если во время реакции теплота выделяется); Т — абсолютная температура, К; R— газовая постоянная, равная 8,32 Дж/ (моль К).
В общем случае массы веществ, которые принимают участие в реакции, надо выражать через активность и вместо Кс пользоваться константой равновесия Ка.
Уравнение изобары
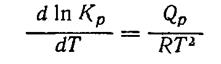 (16)
(16)
можно применить для определения неизвестной константы равновесия К, при температуре Т2 при известной Кр, при Т1 и известным тепловым эффектом реакции при постоянном давлении,Qp в виде уравнения
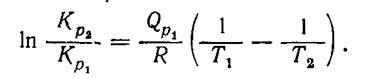 (17)
(17)
Подставляя значение R в уравнение (39) и переходя к десятичным логарифмам, получаем:
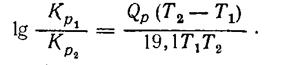 (18)
(18)
Уравнение (17) и (18) найдем интегрированием уравнения (38) при постоянному значении Qp(определенном при Т1), поэтому их можно применять в небольшому интервале температур, когда Qp почти не изменяется. Для вычисления К при значительных изменениях температуры применяют более простое уравнение, а именно:
 (19)
(19)
где а — константа.
Эти самые расчеты вместе с правилом фаз и законом распределения вещества можно применить для нахождения констант равновесия гетерогенных процессов.
Равновесие фаз в многофазных системах определяется правилом фаз, которое дает возможность вычислять степень свободы, т.е. количество факторов (t,p,c1,c2),которые можно изменять независимо один от другого, не изменяя количество фаз
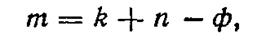 (20)
(20)
где m— число ступеней свободы, или вариантность системы, k— количество компонентов в системе; n— количество внешних параметров, которые влияют на равновесие фаз; ф — количество фаз.
Как правило, на равновесие влияют температура и давление. поэтому п=2. Если рассматривать реагирующую систему при постоянном давлении, то
п = 1. Определение степеней свободы и установление их физической сущности т.е. выяснение, при каких физико-химических условиях можно достичь изменения состояния равновесия системы имеет большое значение при проведении технологичного процесса.
Из правила фаз вытекает, что чем больше число фаз при данном количестве компонентов, тем меньше степеней свободы в системе, т.е. тем меньше изменяется система. Важно, что правило фаз в одинаковой мере касается «физических» и «химических» равновесий и ограничивается данными, связанными с количеством компонентов и фаз, независимо от молекулярной сложности равновесной системы.
В технологии равновесные многокомпонентные системы часто изображают в виде плоских и пространственных диаграмм состояния, в которых одна из свойств системы, например температура плавления или температура кипения, определяется как функция состава. Диаграммы состояния, которые строят на основе экспериментальных данных, дают полное представление о равновесном состоянии системы.
Если время, нужное для достижения равновесного состояния химической реакции, очень большое, то процесс заканчивают раньше, чем будет достигнуто равновесное состояние. Равновесной диаграммой пользуются лишь как показателем той границы, к которой можно было бы дойти при определенных физико-химических условиях.
Дата публикования: 2014-11-18; Прочитано: 667 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
