 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вопрос №10. (лучше конечно, ответ на этот вопрос посмотреть в 81 методичке на странице 83)
|
|
(лучше конечно, ответ на этот вопрос посмотреть в 81 методичке на странице 83)
Цель работы: изучение различных изопроцессов протекающих в газах, экспериментальное определение СP/СV для воздуха.
Приборы и принадлежности: прибор Клемана – Дезорма манометр, насос, секундомер.
Теоретическое введение: Теплоёмкостью какого-либо тела Сm называется величина, численно равная количеству теплоты dQ, которое требуется сообщить этому телу для повышения его температуры на 1 кельвин.
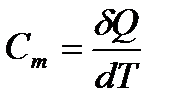
Удельной теплоёмкостью С уд. называется теплоёмкость единицы массы вещества. Молярной теплоёмкостью вещества называется С – называется теплоёмкость вещества взятого в количестве одного моля. Из определения С следует, что С = Суд´m, где m - молярная масса вещества.
Согласно основному закону термодинамики количество теплоты dQ, переданное газу, затрачивается на увеличение его внутренней энергии dU и на совершении газом работы dA.
dQ = dU + dA;
Внутренняя энергия системы является функцией её состояния, а количество теплоты и работа являются функцией процесса.
Из определения теплоёмкости имеем формулу:

Теплоёмкость С так же является функцией процесса так, как передаваемая газу количество теплоты dQ способа нагрева газа.
Состояние газа, как термодинамической системы определяется следующими параметрами: давлением p, объёмом V и температурой T. Связь данных параметров определяется Уравнением состояния идеального газа – уравнением Менделеева-Клайперона:
pV = RT.
Где R – универсальная газовая постоянная.
Процессы, протекающие в газе при неизменном значении одного из термодинамических параметров его состояния, называются изопроцессами.
Изохорный процесс протекает при V = const. Уравнение изохоры имеет вид: 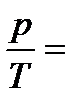 const (закон Шарля). В данном случае dV = 0, dA = pdV = 0. Тогда из уравнения (2) получаем:
const (закон Шарля). В данном случае dV = 0, dA = pdV = 0. Тогда из уравнения (2) получаем:

Изобарный процесс протекает при p = const. Уравнение изобары имеет вид: 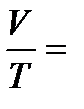 const (закон Гей-Люссака). Теперь уравнения (2) имеет вид:
const (закон Гей-Люссака). Теперь уравнения (2) имеет вид:
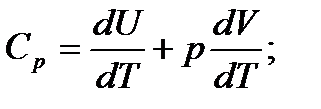
Тогда из уравнения (3) получаем:

При p = const получим pdV = RdT, подставим его в (5) и учтя выражение (4) имеем следующее выражение (уравнение Майера):
Cp = CV + R;
Молярные теплоёмкости Cp и CV идеального газа зависят от числа степеней свободы i его молекулы. Атом одноатомного газа имеет i = 3 (X, Y, Z). Молекулы 2-ух атомного газа имеют i = 5 (3 – степени свободы поступательного движения и 2 вращательного). Молекулы состоящие из 3-ёх и более атомов имеют 6 степеней свободы (i = 6).
При высоких температурах кроме поступательного и вращательного движения молекулы (атома) необходимо учитывать и её колебательное движение (около положения равновесия) т. е. У двухатомной молекулы – 1 колебательная степень свободы, у многоатомных молекул 3N – 6, где N – число атомов в молекуле. На каждую степень свободы приходится примерно одинаковое количество кинетической энергии, равное kT/2, где k – постоянная Стефана – Больцмана. Тогда внутренняя энергия одного моля идеального газа равна:
 ,
,
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы.
Из уравнений (4), (7) и (8) следует, что:
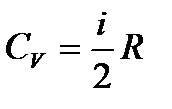 ,
, 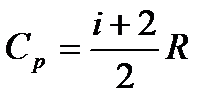 .
.
Изотермический процесс протекает при T = const. Уравнение изотермы имеет вид:  const (закон Бойля - Мариотта). Следовательно:
const (закон Бойля - Мариотта). Следовательно:
dT = 0, dU = 0, dQ =dA.
Адиабатный процесс протекает при dQ = 0. Следовательно: dU + dA = 0. От сюда получаем выражение:
dA = -dU.
Из данного выражения получаем уравнение адиабаты:
pdV = -CVdV (уравнение Пуассона).
Из вышеприведённых уравнений (6), (7) и (11) следует, что:
 ,
,
где
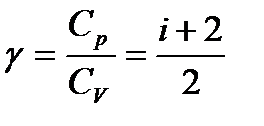 .
.
Интегрируя и потенцируя (12), получим уравнение Пуассона:
pVg = const.
| V |
| p |
| 1 p1, V1, T1 |
| 2 p2, V2, T2 |
| 3 p3, V2, T1 |
| Рис.1 |
В данной работе требуется определить СP/СV = g, для этого в течение всего эксперимента газ (в установке) последовательно будет проходить через 3 состояния (рис. 1): 1-2 адиабатное расширение, 2-3 изохорный процесс.
Для адиабатного перехода 1-2 справедливо уравнение Пуассона:
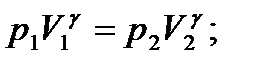
Первое и третье состояние газа принадлежит одной той же изотерме. Применяя к ним закон Бойля – Мариотта, получаем:
p1V1 = p3V2;
Из уравнений (14) и (15) следует, что
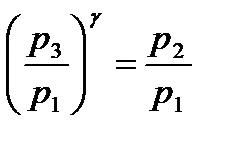 .
.
Прологарифмировав это выражение получим:
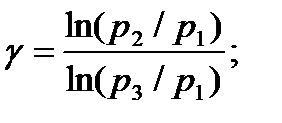
Давление воздуха в баллоне в первом состоянии определяется, как
p1 = p2 + rgH,
где r - плотность вещества; g – ускорение свободного падения; H – разность уровней жидкости в трубках манометра при измерении p1.
Давление воздуха в баллоне в третьем состоянии определяется, как
p3 = p2 + rgh,
где h – разность уровней жидкости в трубках манометра при измерении p3.
Так, как давление p1 и p3 примерно равно атмосферному давлению p2, то формулу (17) можно упростить, использую следующее равенство:
 , которое выполняется для всех x << 1. Тогда:
, которое выполняется для всех x << 1. Тогда:
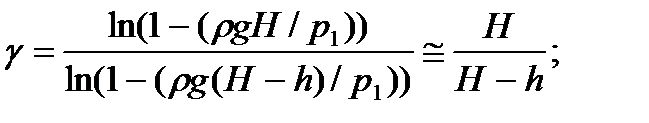
Дата публикования: 2014-11-18; Прочитано: 255 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
