 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вопрос №2. Где — давление, — молярный объём, — универсальная газовая постоянная — абсолютная температура
|
|
Уравнение состояния идеального газа (уравнение Клапейрона или уравнение Менделеева — Клапейрона)
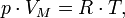
где
-
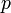 — давление,
— давление, -
 — молярный объём,
— молярный объём, -
 — универсальная газовая постоянная
— универсальная газовая постоянная -
 — абсолютная температура, К.
— абсолютная температура, К.
Так как  , где
, где 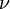 — количество вещества, а
— количество вещества, а 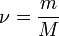 , где
, где 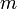 — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
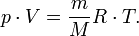
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
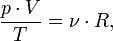
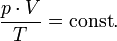
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
 — Закон Гей-Люссака.
— Закон Гей-Люссака.
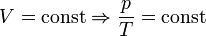 — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции 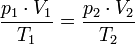 этот закон удобен для расчёта перевода газа из одного состояния в другое.
этот закон удобен для расчёта перевода газа из одного состояния в другое.
Универсальная газовая постоянная (физический смысл) —величина численно равна работе, которую необходимо совершить, чтобы нагреть 1 моль вещества на 1 К при постоянном давлении.
В Международной системе единиц (СИ) универсальная газовая постоянная равна 8,31441 Дж/(моль*К)
Постоянная Больцмана ( или
или 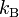 ) — физическая постоянная, определяющая связь между температурой и энергией.
) — физическая постоянная, определяющая связь между температурой и энергией.
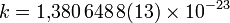 Дж/К
Дж/К
Универсальная газовая постоянная определяется как произведение постоянной Больцмана на число Авогадро, 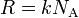 .
.
Дата публикования: 2014-11-18; Прочитано: 260 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
