 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Межфазные взаимодействия между конденсированными фазами
|
|
К межфазным взаимодействиям между конденсированными фазами относятся смачивание/несмачивание, растекание, адгезия и когезия.
Адгезией (от лат. adhaesio — прилипание) называют межфазное взаимодействие между поверхностями конденсированных фаз при их молекулярном контакте. Работа адгезии Wa — это работа обратимого разрыва адгезионной связи между двумя фазами, отнесенной к единице площади. При этом происходит образование новых поверхностей раздела каждой из этих фаз с воздухом (на это затрачивается энергия (σжг + σтг)) и разрушение границы раздела контактировавших фаз (– σтж). В результате работа адгезии в системе ж/т:
Wa = σЖГ+ σТГ – σТЖ (2.1)
Это уравнение (уравнение Дюпре) отражает закон сохранения энергии при адгезии. В этом случае энергия затрачивается на образование двух поверхностей раздела, равных по величине, но разных по свойствам. Соответственно, изменения свободной энергии связаны с заменой свободной энергии исходной межфазовой границы на свободную энергию поверхностей фаз, граничащих с собственным паром.
Работу адгезии можно рассматривать как меру интенсивности взаимодействия двух разных контактирующих фаз, т.е. степени взаимного насыщения нескомпенсированных поверхностных сил, причем член σтж определяет интенсивность остаточных нескомпенсированных связей (чем больше σтж, тем меньше при прочих равных условиях величина Wa).
В отличие от адгезии, которая характеризует взаимодействие между поверхностями разных фаз, когезия отражает связь внутри одной фазы, характеризуя прочность конденсированной фазы и способность тел противодействовать внешнему усилию. Работу когезии Wk определяют как работу разрыва однородной гомогенной фазы с образованием двух новых поверхностей раздела этой фазы с ее собственным паром. В простейшем случае, работа когезии (Wk) определяется затратой энергии на обратимый изотермический разрыв фазы, отнесенной к единице площади:
Wk = 2σЖГ (2.2),
где множитель 2 указывает на образование двух новых одинаковых по величине и свойствам поверхностей раздела ж/г. В итоге работу когезии можно рассматривать как меру межмолекулярного взаимодействия в объеме гомогенной конденсированной фазы.
Соотношение между работами адгезии и когезии можно выразить с помощью следующих уравнений:
Wa /Wk = 0.5 (1 + Cos θ) (2.3)
или
Wa = σЖГ (1+ Cos θ) (2.4)
Уравнение (2.4) удобно тем, что позволяет исключить трудно определяемые экспериментально величины σТГ и σТЖ, в то время как значения σЖГ и Cosθ измеряются довольно легко.
В зависимости от соотношения между силами адгезии между жидкостью и твердым телом и силами когезии внутри жидкости возможны следующие результаты при нанесении небольшого количества жидкости на поверхность твердого тела: несмачивание, смачивание и растекание.
Смачивание – поверхностное явление, которое возникает в результате взаимодействия жидкости с твердым телом или другой жидкостью при наличии одновременного контакта с воздухом. Общая граница контакта трех фаз называется линией смачивания.
Количественной характеристикой смачивания является краевой угол (θ) – угол между касательной к поверхности капли и смачиваемой поверхностью (рис. 2.1), причем вершина угла лежит на линии смачивания. Краевой угол θ отсчитывается в сторону жидкости, а при избирательном смачивании – в сторону более полярной из двух жидкостей.
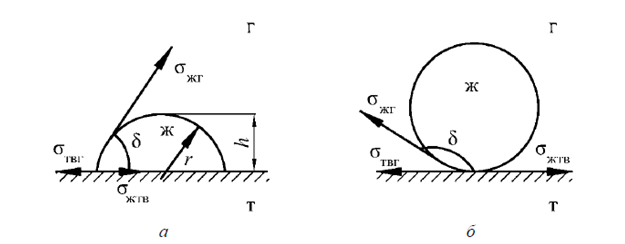
Рис. 2.1. Схема смачивания жидкостью поверхности твердого тела: а – капля жидкости на смачиваемой поверхности (δ < 90°); б – капля жидкости на несмачиваемой поверхности (δ > 90°).
Чем меньше краевой угол, тем выше смачивание и наоборот. Величина смачивания определяется результатом конкуренции сил межмолекулярного притяжения внутри жидкости (сил когезии) и сил молекулярного взаимодействия между жидкостью и твердым телом (сил адгезии).
В зависимости от молекулярной природы жидкости и твердого тела могут наблюдаться три частных случая.
1. Если молекулы жидкости взаимодействуют с молекулами твердого тела сильнее, чем между собою, то капля растекается по поверхности, образуя мениск с острым краевым углом (0° < θ < 90°) (см. рис. 4,а) или
тонкую пленку с краевым углом θ = 0°. Последний случай (θ = 0°) называется полным смачиванием (вода на обезжиренной поверхности стекла или кварца).
2. Если же молекулы жидкости взаимодействуют друг с другом сильнее, чем с молекулами твердого тела, то капля стягивается, образуя тупой краевой угол θ > 90° (см. рис. 4,б), как в случае воды на парафине или фторопласте. Случай θ = 180° (полное несмачивание) является гипотетическим, т.к. он означал бы полное отсутствие молекулярного взаимодействия между фазами, что нереально.
3. Между этими крайними случаями наблюдаются различные промежуточные, когда капля жидкости образует с поверхностью краевой угол θ, который является мерой смачивания (рис.2.1,а).
По измерению краевого угла все поверхности делятся на две группы: гидрофильные и гидрофобные. Если вода на твердой поверхности образует угол 0° < θ < 90°, то такую поверхность называют гидрофильной, если угол θ > 90°, то поверхность является гидрофобной.
Тела, для которых в условиях избирательного смачивания краевой угол θ < 90о (Cos θ > 0), называются гидрофильными, а в обратном случае (θ > 90о, Cos θ < 0) – гидрофобными (или олеофильными).
Гидрофильными телами являются, например, оксиды и гидроксиды металлов, большинство неорганических солей – силикаты, сульфаты, карбонаты и др., из органических соединений гидрофильна целлюлоза (благодаря наличию в структуре макромолекулы большого количества полярных ОН- групп).
К гидрофобным телам относятся органические вещества с большим содержанием СН-связей (парафиновые и ароматические углеводороды, вещества с полярными группами, но большим углеводородным радикалом, например, средние и высшие жирные кислоты). Из неорганических веществ гидрофобны сера, графит, многие сульфиды, чистые металлы.
Смачивание можно рассматривать как процесс, при котором в системе из трех соприкасающихся фаз происходит уменьшение свободной поверхностной энергии. Если удельная свободная поверхностная энергия на границе твердого тела и жидкости меньше, чем на границе твердого и газа (σТЖ < σТГ), то энергетически выгодно растекание жидкости (смачивание), при котором поверхность с высокой энергией частично заменяется на поверхность с меньшим запасом свободной энергии. И наоборот, если σТЖ > σТГ, то энергетически выгодно несмачивание.
Условие равновесного смачивания выражается уравнением Юнга:
σТГ = σТЖ + σЖГ cosθ (2.5)
 (2.6)
(2.6)
Из уравнения Юнга вытекают некоторые следствия:
1) Различные жидкости тем лучше смачивают данную твердую поверхность, чем ниже поверхностное натяжение жидкости.
2) Смачиваемость твердых тел тем больше, чем выше их свободная поверхностная энергия. Поэтому, в общем, смачиваемость повышается в ряду: тела с молекулярной кристаллической решеткой < с полярными связями < с ионной кристаллической решеткой.
Парафин, сера, уголь смачиваются хуже, чем оксиды, соли, силикаты.
3) При избирательном смачивании из двух жидкостей смачивать данную твердую поверхность будет та, полярность которой ближе к полярности твердого тела. Другими словами смачивающей будет та жидкость, у которой меньше разность полярностей с данным твердым телом, т.е. она более близка к нему по молекулярной природе, проявляет более сильное межмолекулярное взаимодействие с ним и обеспечивает, следовательно, более низкое значение величины σТЖ.
Из уравнений (2.3-2.4) также следует:
при θ= 00 Cos θ = 1.0 Wa /Wk = 1.0 (полное смачивание),
900 > θ > 00 1> Cos θ > 0 0.5 < Wa /Wk < 1.0 (смачивание),
θ= 900 Cos θ = 0 Wa /Wk = 0.5 (равновесие)
1800>θ >900 0> Cos θ > -1 0 < Wa /Wk < 0.5 (несмачивание)
При равенстве работ когезии и адгезии контактный угол θ=00, а условие Wa/Wk > 1.0 приводит к неограниченному растеканию (это же условие является необходимым условием последующего растворения). Движущую силу растекания определяют как разницу работ адгезии и когезии и называют работой растекания.
Неограниченное растекание жидкости. Как отмечено выше, положительное или отрицательное смачивание зависит от соотношения работ адгезии и когезии смачивающей жидкости. При полном смачивании (Wа = Wk) жидкость образует на поверхности тонкую пленку (в пределе – мономолекулярную), при этом краевой угол θ = 0°. Возможен случай, когда жидкость обладает столь высоким молекулярным сродством к поверхности («фильностью»), что адгезионные силы будут превышать силы когезии (Wа > Wk), и тогда происходит процесс, называемый неограниченным растеканием жидкости: ее межмолекулярные связи разрушаются в результате адгезии, и поверхностная пленка переходит из жидкого в газообразное состояние: молекулы жидкости занимают всю доступную поверхность, подобно тому, как газ занимает весь объем сосуда (происходит поверхностное испарение). Величина f = Wа – Wk называется коэффициентом растекания (коэффициентом Гаркинса). Его можно выразить через величины поверхностного натяжения, подставляя значения Wа и Wk:
f = (σТГ + σ ЖГ – σТЖ) – 2 σ ЖГ = (σТГ – σ ТЖ) - σЖГ = σЖГ·cosθ - σЖГ
f = σЖГ (cosθ - 1) (2.7)
При отрицательных значениях f происходит ограниченное растекание с установлением конечного значения краевого угла. Условие неограниченного растекания: f > 0.
Величина адгезии всегда больше нуля, т.к. между соприкасающимися фазами всегда имеется какое-либо, пусть очень небольшое межмолекулярное взаимодействие. Поэтому ситуация, когда Wa=0 и угол θ=1800, невозможна.
Тепловой эффект смачивания обусловлен межмолекулярным взаимодействием на границе Т/Ж, в результате которого при нанесении жидкости на твердое тело происходит убыль не только свободной поверхностной энергии, но и полной поверхностной энергии (поверхностной энтальпии). Межмолекулярное взаимодействие тем сильнее, чем меньше разность полярностей жидкости и твердого тела. Поэтому тепловой эффект смачивания гидрофильных тел водой больше, чем углеводородами и наоборот – для гидрофобных тел он ниже, чем при смачивании их углеводородами. Различают дифференциальную и интегральную теплоты смачивания.
Дифференциальная теплота смачивания λd – теплота, выделяющаяся при нанесении бесконечно малого количества жидкости на поверхность, уже содержащую некоторое количество жидкости (слой толщиной x). Эта теплота максимальна при x = 0 и убывает до λd = 0 при некоторой толщине x = h, равной расстоянию, на котором интенсивность поля ненасыщенных молекулярных сил поверхности спадает до нуля. Ее относят к 1 моль смачивающей жидкости: [λd] = Дж/моль.
Интегральная теплота смачивания λi - теплота, выделяющаяся при
нанесении некоторого конечного количества жидкости x на исходную
(сухую) поверхность:
λi = 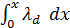 (2.8)
(2.8)
При x → h величина λi возрастает до λi = λmax,где λmax – полная интегральная теплота смачивания, отвечающая полному заполнению поверхностного слоя с единичной площадью: [λi] = Дж/м2.
Теплоты смачивания используют для оценки поверхностных молекулярных свойств тела и количественной характеристики смачиваемости, когда невозможно экспериментально определить значение краевого угла: в случае порошкоообразных, волокнистых, пористых тел. Чтобы избежать измерений межфазной поверхности таких тел, в качестве термической характеристики смачиваемости используют отношение полных теплот смачивания тел водой и углеводородом:
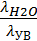 = β (2.9)
= β (2.9)
где λH2O и λУВ - полная интегральная теплота смачивания водой и углеводородом, соответственно; β - термический коэффициент смачивания. Если β > 1, то тело гидрофильно, при β < 1 тело гидрофобно.
Дата публикования: 2014-11-19; Прочитано: 2501 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
