 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон эквивалентов
|
|
Эквивалентом называется такое количество вещества (моль), которое без остатка соединяется с одним атомом водорода или замещает то же его количество в химических реакциях.
Масса одного эквивалента вещества – это его эквивалентная масса M Э [г/моль].
Эквивалент вещества, а, следовательно, и эквивалентная масса зависят от валентности элементов.
Валентность – способность атома образовывать определенное число ковалентных связей.
За единицу валентности принимают валентность атома водорода, которая равна 1.

А поскольку все элементы образуют соединения с кислородом и учитывая, что атом кислорода всегда присоединяет два атома одновалентного элемента, нетрудно определить валентности.

Эквивалентная масса элемента определяется из соотношения:

где А эл. – атомная масса элемента, г/моль.
При определении эквивалентной массы оксида удобно пользоваться формулой:
М э,оксида = М э,эл. + 8,
где М Э,эл. – эквивалентная масса элемента, г/моль;
8 – эквивалентная масса кислорода в оксидах, величина постоянная, найденная из соотношения 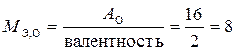 г/моль.
г/моль.
Эквивалентная масса вещества В (M Э,В) определяется из соотношения
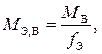
где M B– молярная масса вещества В, г/моль;
f Э – эквивалентное число (фактор эквивалентности).
При вычислении эквивалентных масс кислот, оснований или солей эквивалентные числа определяются:
f Э (кислоты) – числом ионов H + (например, для H2SO4, f Э = 2);
f Э (основания) – числом ионов OH – ( например, дляAl(OH)3, f Э = 3);
f Э (соли) – суммарным зарядом всех катионов данной соли (например, Al(OH)2Cl, f Э = 1, Al2(SO4)3; f Э = 6 и т.д.).
Эквивалентное число и молярная масса эквивалента – величины не постоянные и зависят от стехиометрии реакции, в которой они принимают участие.
f Э определяется в:
– кислотно-основных реакциях f Эопределяется числом замещенных ионов водорода;
– окислительно-восстановительных реакциях f Эопределяется числом принятых или отданных электронов;
– реакциях комплексообразования – числом зарядов катионов металла, которые принимают участие в образовании молекулы комплексного иона;
– реакциях осаждения – числом зарядов катионов металла, участвующих в образование малорастворимого соединения.
Например, реакция нейтрализации гидроксида натрия (NaOH) фосфорной кислотой (H3PO4) может протекать с образованием кислых
(1, 2) и средней (3) солей:
1) 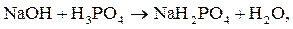
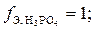
2) 

3) 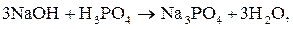

В первом случае только один ион водорода фосфорной кислоты замещается на катион металла, отсюда и эквивалентное число равно единице. Во втором случае два иона водорода фосфорной кислоты замещаются на ионы металла, следовательно,  В третьем случае три иона водорода кислоты замещаются на катионы натрия,
В третьем случае три иона водорода кислоты замещаются на катионы натрия, 
Окислительно-восстановительные реакции. Рассмотрим на примере восстановления 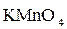 (ионов
(ионов 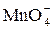 ) в зависимости от реакции среды.
) в зависимости от реакции среды.
Полуреакция

выражает восстановление ионов 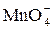 в ионы
в ионы 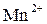 в кислой среде (рН < 7), в результате чего происходит принятие пяти электронов, следовательно,
в кислой среде (рН < 7), в результате чего происходит принятие пяти электронов, следовательно, 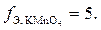
В щелочной среде (рН > 7) ионы 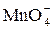 восстанавливаются до молекулы оксида марганца (IV)
восстанавливаются до молекулы оксида марганца (IV) 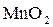 , что выражается полуреакцией
, что выражается полуреакцией
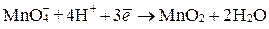 ,
,
в результате которой происходит принятие трех электронов. Следовательно, 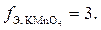
В нейтральной среде ионы 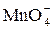 восстанавливаются до ионов
восстанавливаются до ионов 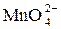 , что связано с принятием только одного электрона:
, что связано с принятием только одного электрона:
 , а
, а 
Так, для 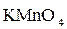 , в зависимости от реакции среды, f Э может принимать значения 1, 3 или 5.
, в зависимости от реакции среды, f Э может принимать значения 1, 3 или 5.
Реакции комплексообразования. Рассмотрим на примере реакции образования гексацианоферрата (II) калия-цинка (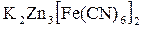 ), которая протекает по схеме
), которая протекает по схеме
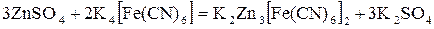
и определим f Э гексацианоферрата калия (K4[Fe(CN)6]). В двух молях гексацианоферрата (II) калия было замещено шесть ионов калия тремя ионами цинка, следовательно, в каждой молекуле было замещено 3 иона калия, или во взаимодействии с каждой молекулой приняли участие 3 иона цинка, следовательно, 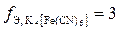 .
.
 Реакции осаждения. Разберем на примере образования сульфата бария (
Реакции осаждения. Разберем на примере образования сульфата бария ( ) по реакции
) по реакции

В данной реакции участвует один катион бария с зарядом иона +2 ( ), отсюда
), отсюда 
Закон эквивалентов (Рихтер, 1792-1794 гг.). Массы, объемы реагирующих веществ прямо пропорциональны их эквивалентным массам (M Э), эквивалентным объемам (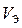 ).
).
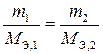 ,
, 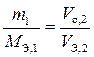 ,
,  .
.
Математическая запись закона эквивалентов представлена в трех вариантах через:
– массы реагирующих веществ;
– массы и объемы реагирующих веществ;
– объемы реагирующих веществ.
Эквивалентным объемом называется объем одного эквивалента вещества 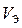 [л/моль]. Имеет смысл только для газообразных веществ и может быть определен следующим образом:
[л/моль]. Имеет смысл только для газообразных веществ и может быть определен следующим образом:
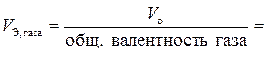
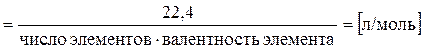 ,
,
где V o – мольный объем газа, т.е. объем, занимаемый газом при нормальных условиях (Р о = 760 мм рт. ст. = 101325 Па; То = 273 K), л.
Например:
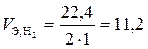 л/моль;
л/моль;
 л/моль;
л/моль;
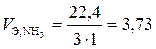 л/моль.
л/моль.
Дата публикования: 2014-11-18; Прочитано: 4010 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
