 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Болат қорыту үрдісінде физикалық химияның заңдарын қолдану
|
|
Конвертерлік болат қорыту-күрделі үрдіс. Болат қорыту барысында үрлеме әсерінен шойын элементтері тотығып, қожтүзгіш материалдармен қож түзіліп, шеген-металл-қож-газ жүйесінде физика-химиялық үрдістер орын алады. Сондықтан болат қорыту үрдісін басқаруда физикалық химияның заңдарына сүйенеді. Металл мен қождағы әр түрлі түрленістердің энергетикалық жағдайын, үрдіс мүмкіндігін, бағытын және тепе-теңдігін анықтауда термодинамиканың жалпы заңдарына, ал орын алып жатқан үрдістердің жылдамдығын анықтауда кинетиканың заңдарына сүйенеді [1, 2].
Жылу тепе-теңдігін және жылудың энергияның басқа түрлеріне түрлену заңдарын зерттейтін ғылымды термодинамика деп атайды. Химиялық термодинамикада термодинамиканың жалпы заңдарын физика-химиялық үрдістерге қолдану қарастырылады [1]:
1) белгілі жағдайда химиялық реакциялардың немесе фазалық түрленістердің өздігінен өту мүмкіндігін білу;
2) әр түрлі заттардың тепе-теңдікте болу шарттарын тағайындау;
3) химиялық реакциялар мен фазалық түрленістердің термо-химиялық эффектін анықтау.
Болат металлургиясында қолданылатын термодинамиканың негізгі қағидалары. Термодинамикада әр түрлі жүйелер зерттеледі. Зерттеу үшін қоршаған ортадан бөлініп алынған денелер тобын жүйе деп атайды. Конвертердің шегені, металы, қожы және газ атмосферасы жүйе мысалы бола алады. Физика-химиялық жүйесінің күйі фаза және компонент санымен сипатталады. Жүйенің басқа бөлігінен бет аралық бөлінген, оның біртекті бөлігін фаза дейді. Жүйені құратын заттарды компонент деп атайды. Жүйе гомогенді (бір фазалы) және гетерогенді (көп фазалы) болып бөлінеді. Жүйе гомогенді, егер оның барлық бөлігі құрамы және қасиеті бойынша бірдей болса. Қасиеттері әр түрлі жүйе бөліктері (фазалары) бір-бірімен бет аралық бөлінсе, онда жүйе – гетерогенді.
Жүйе күйін термодинамикалық параметрлер – температура, қысым, көлем, концентрация және т.б. сипаттайды. Жүйе күйі параметрлерінің өзгеруінен термодинамикалық үрдіс орын алады.
Күй параметрлерінің өзгеруіне байланысты жүйедегі өзгерістерді, яғни үрдісті сипаттайтын шамаларды үрдіс параметрлері деп атайды.
Болат қорыту үрдісі негізінен изобаралық жағдайда (қысым тұрақты) өтетіндіктен, термодинамикалық есептеулерде Гиббс энергиясының (∆G), энтальпияның (∆H), жылу эффектісінің (Qp) өзгеру мәндері қолданылады.
 |
Негізгі термодинамикалық функциялардың ара қатынасын сұлба ретінде келтіруге болады (1.1 сурет). Заттың жалпы энергия қорын ішкі энергия (U) деп атайды. Химиялық реакциялардың жүру нәтижесінде ішкі энергия не азайып, не көбейіп өзгереді (∆U). Термодинамикалық есептеулерде ∆U мәнін білу жеткілікті.
Қысым тұрақты болғанда энтальпия мен ішкі энергия арасында қатынас мынандай [1]
H=U+pV (1.1)
мұндағы
Н - энтальпия;
U - ішкі энергия;
pV - сыртқы ортаға шығатын көлемдік энергия.
Қатты және сұйық затқа үлкен қысым түссе немесе зат газ күйінде болса, онда көлемдік энергияның мәні едәуір. Аз қысым түсетін қатты және сұйық үшін pV мәні өте аз, сондықтан энтальпия мен ішкі энергия өзара тең деуге болады.
Энтальпияның абсалюттік шамасының өзгеруі жылу эффектісіне тең. Егер реакция кезінде жылу шығарылса, онда жылу эффекті оң (+Qp). Бұндай реакцияны экзотермиялық деп атайды. Жүйе энтальпиясының өзгеруі теріс (∆H<0). Бөлініп шыққан жылу шамасына жүйенің энталпиясы кемиді, яғни Qp= –∆H.
Егер реакция кезінде жылу сіңірілсе, онда жылу эффекті теріс (–Qp). Реакция эндотермиялық. Жүйе энтальпиясының өзгеруі оң (∆H>0). Сонда –Qp=∆H.
Термодинамиканың екінші заңы бойынша ішкі энергияның толықтай жұмысқа түрленуі мүмкін емес. Ішкі энергияның жұмысқа түрленбейтін бөлігін байланған энергия, ал энергияның жұмысқа түрленетін бөлігін бос энергия (F) деп атайды. Байланған энергия температура мен энтропияның көбейтіндісіне (TS) тең.
Көлем тұрақты болғанда жүйенің немесе заттың бос энергиясының өзгеруін төмендегі теңдеумен көрсетуге болады
∆Fv=∆U – T∆S (1.2)
(U–TS) функциясы көлем тұрақты болғандағы бос энергияны сипаттайды.
Температурасы мен қысымы тұрақты келген жүйе үрдісінің жүру мүмкіндігінің бағытын көрсететін функцияны Гиббс энергиясы деп атап, мына теңдеумен анықтайды
G = H – TS (1.3)
немесе
∆G = ∆H – T∆S (1.4)
Термодинамиканың екінші заңы бойынша изобара-изотермиялық жүйе үрдісі өздігінен жүре алады, егер жүйенің бос энергиясы кемитін болса. Егер ∆G<0 болса, онда үрдіс (реакция) тура бағытта жүре алады. Егер ∆G=0 болса, реакцияның тепе-теңдік күйіне жеткені. Егер ∆G>0 болса, реакция тек кері бағытта жүре алады.
Реакцияның қай бағытта қандай дәрежеде жүретінін тепе-теңдік константасы (Кр) көрсетеді. Бос энергия өзгеруі мен реакцияның тепе-теңдік константасының арасында мынандай қатынас бар [1]
ΔG= 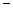 RT· ln Kp (1.5)
RT· ln Kp (1.5)
мұндағы
R – газ тұрақтысы.
Егер ∆G=∆H–T∆S десек, онда
R ln Kp=ΔS–ΔH/T (1.6)
Соңғы теңдеуден (1.6) ∆S мәні неғұрлым үлкен, ал ∆H мәні неғұрлым кіші болса, соғұрлым реакцияның толымды өтетіні көрінеді. Температура жоғарылаған сайын энтропиялық фактор артып, энтальпиялық фактор кемиді.
Теңдеуге (1.5) газ тұрақтылығының мәнінқойып, натурал логарифмді ондыққа ауыстырсақ, қолдануға ыңғайлы мына формула алынады
∆G= –19,155T· lg Kp (1.7)
Бос энергия өзгеруінің таңбасы тепе-теңдіктің ығысу бағытын анықтаса, оның шамасы ығысу дәрежесін көрсетеді.
Болат қорыту реакциялары константасының мәнін эксперименттік және есептік жолмен анықтайды. Практикалық есептеулер үшін бос энергияның өзгеруін үрдістің (реакцияның) стандарттық жағдайында анықтау ыңғайлы болады. Стандарттық күйде әрбір компоненттің парциалдық қысымы 100 кПа, активтілігі бірге тең деп қабылданады. Стандарттық температураны 25°С-ға тең, яғни 298К деп алып, параметр шамаларын ∆G°, ∆H°, ∆S° деп белгілейді.
Теңдеуден (1.7) lg Kp табамыз, сонда
lg Kp= –∆G0/19,155 Т (1.8)
мұндағы
∆G0 – реакцияға қатысушы стандартты күйдегі заттардың бос энергиясының өзгеруі.
Теңдеуге (1.8) ΔG=ΔH 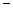 TΔS қойсақ мына формула шығады
TΔS қойсақ мына формула шығады
lg Kp= –∆H0/19,155 Т + ∆S0/19,155 (1.9)
Болат қорыту үрдісінің температураларында ∆H0, ∆S0 мәндері аз өзгеретіндіктен, есептеу үшін олардың 16000С-дағы мәндерін алады. Сонда
lg Kp= –∆H01873/19,155 Т + ∆S01873/19,155 (1.10)
Идеал жүйенің кейбір заңдарын нақты жүйе үрдісінде қолдану. Физика-химиялық үрдістерді зерттеуде, идеал жүйенің де қағидаларын пайдаланады. Идеал газ үшін молекула аралық күш әсері мен молекулалардың көлемін есепке алмайды. Сонда физика-химиялық тепе-теңдік теңдеулері ықшамдалады. Енді оларды қасиеттері бойынша идеалға жақын жүйелерге, яғни сиреген газ бен сұйытылған ерітіндіге қолдануға болады [3]. Жоғары температура мен төменгі қысымдағы нақты газдың қасиеттері идеал газға жақын.
Болат балқымасының көптеген компоненттерінің темірдегі ерітінділері идеал күйге жақындай қоймайды. Бірақ кейбір компоненттердің темірдегі мөлшері аз. Ерігіш заттың концентрациясы азайғанда, нақты ерітіндінің қасиеті идеалға жақындайды. Бұндай ерітіндіні сұйытылған деп атайды. Сұйытылған ерітіндіге Генри заңын қолдануға болады. Сұйытылған ерітіндінің тепе-теңдік күйінде еріген газдың концентрациясы, оның ерітінді үстіндегі қысымына тура пропорционал
С = L×p (1.11)
мұндағы
С – газ концентрациясы;
L – Генри константасы;
р – газдың парциалдық қысымы.
Газ ерігіштігінің тепе-теңдік константасының температураға тәуелділігі
d ln L/dT=ΔH/RT2 (1.12)
Еріткіш пен ерігіш бөлшектерінің өзара әрекеті әр түрлі болуы мүмкін. Ерігіштің еріткішпен әрекеттесуінің сандық сипаттамасының шамасын, берілген компоненттің ерітіндідегі активтілігі деп атайды.
Идеал күйге арналған заңдарды нақты жүйенің үрдістеріне қолдану үшін тепе-теңдік теңдеулеріндегі концентрация мен парциалдық қысым орнына активтілік (а) пен газ ұшпалығын (f) қолданып, түзетулер енгізеді. Активтілік немесе ұшпалық мәнін анықтау үшін концентрацияны немесе парциалдық қысымды түзету коэффициенті немесе нақты жүйедегі компонент қасиеттерінің идеал жүйедегі қасиеттерінен ауытқу дәрежесі болып табылатын, активтілік коэффициентіне (γ) көбейтеді: а=gi·Сі, fі=gi·pі. Өте сұйытылған ерітіндіде активтілікті концентрацияға немесе мольдік бөлікке тең деп алуға болады: аі=Сі, аі=Ni.
Болат қорыту үрдісінде ерігіш компонент сипаттамасының өзгерісін қарастырғанда Генри заңы қолданылса, еріткіш компонент сыйпаттамасын қарастырғанда Рауль заңы қолданылады. Тепе-теңдік күйде (берілген температурада) ерітінді компоненті буының парциалдық қысымы, оның ерітіндідегі мольдік бөлігіне тура пропарционал
p = p0·N (1.13)
немесе нақты жүйе үшін
p = p0·а (1.14)
мұндағы
р – ерітінді үстіндегі компонент буының парциалдық қысымы;
p0 – таза компонент үстіндегі қаныққан бу қысымы;
N – компоненттің ерітіндідегі мольдік бөлігі;
а – компоненттің ерітіндідегі активтілігі.
Егер екі өзара араласпайтын сұйықтан тұратын гетерогенді жүйеге екі сұйықта да еритін үшінші затты қосса, ол екі сұйық арасында Нернст-Шилов бөліну заңы бойынша бөлінеді. Екі өзара жанасқан, бірақ араласпайтын фазаларда еріген зат концентрациясының немесе активтілігінің қатынасы тепе-теңдік күйде тұрақты температурада тұрақты шама болады
L=(M)/[M]=a(M)/a[M] (1.15)
мұндағы
L – заттың фазалар арасында бөліну коэффициенті немесе константасы;
(М) – заттың қождағы концентрациясы;
[М] – заттың металдағы концентрациясы;
а(М) – заттың қождағы активтілігі;
а[М] – заттың металдағы активтілігі.
Металдың оттегімен тотығуға бейімділігі. Болат өндіруде темір және басқа элементтердің (Si, Mn, C, P және т.б.) оттегімен тотығу үрдісі орын алады
Me+O2=MeO2. (1.16)
Металдың тотығушылығы оттегі-тотық жүйесінің тепе-теңдік жағдайында оттегі қысымының шамасымен анықталады
KP=1/pО2 (1.17)
∆G°=RT ln pО2 (1.18)
Оттегі қысымы неғұрлым аз болса, соғұрлым тотық берік.
Егер металл мен оның тотықтары ерітіндіде бос күйде болмаса, онда
m[MeO]=n[Me]+O2; (1.19)
Kp=рО2аn[Me]/am[MeO] (1.20)
pO2=Kpam[MeO]/аn[Me] (1.21)
Егер металл мен оның тотығы стандарттық күйде болса, олардың активтілігін бірге тең деуге болады, сонда
Kp=рО2=р0О2 (1.22)
Жалпы жағдайда
рО2=р0О2am[MeO]/аn[Me] (1.23)
Оттегі қысымы ерітіндідегі тотықтың активтілігіне тура пропорцианал, ал ерігіш компонент активтілігіне кері пропорционал.
Дата публикования: 2014-11-04; Прочитано: 1476 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
