 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Практическое применение электропроводности
|
|
Зная эквивалентную электропроводность раствора можно рассчитать степень (a) и константу диссоциации (K) растворенного в нем слабого электролита:
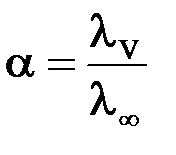
где λV – эквивалентная электропроводность при данном разведении V; λ∞ – предельная эквивалентная электропроводность.
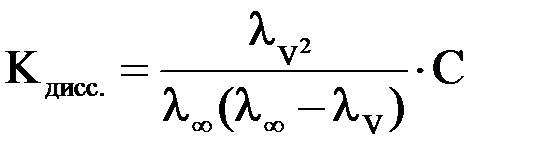
где С – молярная концентрация электролита в растворе.
На измерении удельной электропроводности основан кондуктометрический метод анализа (кондуктометрия). В аналитической химии широкое применение имеет кондуктометрическое титрование. При этом точку эквивалентности фиксируют по резкому изменению удельной электропроводности исследуемого раствора в ходе его титрования. Этот метод удобен при исследовании окрашенных или мутных растворов, в которых трудно заметить изменение окраски индикатора.
Рассмотрим в качестве примера титрование сильной кислоты HCl сильным основанием NaOH:
HCl + NaOH = NaCl + H2O
H+ + OH– = H2O
При постепенном прибавлении раствора NaOH к кислоте ионы H+ и OH– в растворе заменяются менее подвижными ионами Na+ и электропроводность раствора уменьшается. В точке эквивалентности она будет наименьшая. При добавлении избыточного количества щелочи из-за прекращения реакции нейтрализации ионы OH– станут накапливаться в растворе, резко увеличивая его электропроводность. По результатам измерений строят график зависимости электропроводности от объема прибавленного раствора щелочи (рис. 85).
Абсцисса точки пересечения двух прямых соответствует конечной точке титрования, т.е. точке эквивалентности.
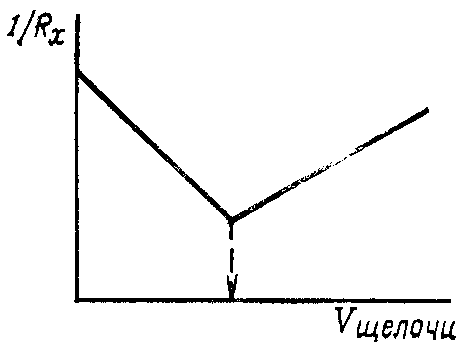
Рис. 85. Кривая кондуктометрического титрования сильной кислоты сильным основанием, (1/Rx – электропроводность раствора)
Методы анализа, основанные на измерении электропроводности, широко применяются для технологического контроля во многих производствах, определения влажности различных объектов, содержания солей в воде, в ряде биологических жидкостей или в почве. По электропроводности растворов можно количественно определять растворимость труднорастворимых соединений, изоэлектрическую точку аминокислот, пептидов и белков.
Дата публикования: 2014-11-03; Прочитано: 1143 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
