 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Эквивалентная электропроводность растворов
|
|
Эквивалентной электропроводностью называется электрическая проводимость раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль химического эквивалента растворенного вещества.
Таким образом, если удельная электропроводность характеризует проводимость единичного объема раствора электролита (в системе СИ – 1 м3), в котором содержание данного вещества может быть различным, то эквивалентная электропроводность характеризует электрическую проводимость раствора, содержащего один моль химического эквивалента растворенного вещества. Причем объем самого раствора может изменяться в широких пределах вплоть до бесконечного при бесконечном разбавлении.
Общее же количество электролита, определяющее величину его эквивалентной электропроводности, остается одним и тем же при любой концентрации и в любом объеме раствора. Схема, объясняющая связь между удельной и эквивалентной электропроводностью вещества, представлена на рис. 83.

Рис. 83. Зависимость между удельной и эквивалентной электрическими проводимостями
Эквивалентная электропроводность обозначается греческой буквой λV (ламбда), причем индексом внизу показывают обычно объем раствора (в м3), в котором содержится 1 моль химического эквивалента электролита.
Эквивалентная электропроводность равна удельной электропроводности 1 м3 раствора, умноженной на объем (V) этого же раствора (в м3), содержащий 1 моль химического эквивалента электролита
λV = ϰ ∙ V
Учитывая, что 1/V = С (молярная концентрация эквивалента электролита в растворе, моль/м3)
λV = ϰ/C
Эквивалентная электропроводность измеряется в
См ∙ моль–1 ∙ м2 или Ом–1 ∙ моль–1 ∙ м2. В справочной литературе эквивалентную электропроводность часто приводят в единицах измерения См ∙ моль–1 ∙ см2 или Ом–1 ∙ моль–1 ∙ см2. (При этом удельная электропроводность ϰ выражается в
Ом–1 ∙ см–1 или См ∙ см–1, молярная концентрация эквивалента в моль/см3).
Эквивалентная электропроводность зависит от тех же факторов, что и удельная.
Для сильных и слабых электролитов λV возрастает с уменьшением концентрации раствора, достигая максимального значения при достаточно большом разбавлении V (рис. 84). Она называется иначе предельной электрической проводимостью и обозначается λ∞.
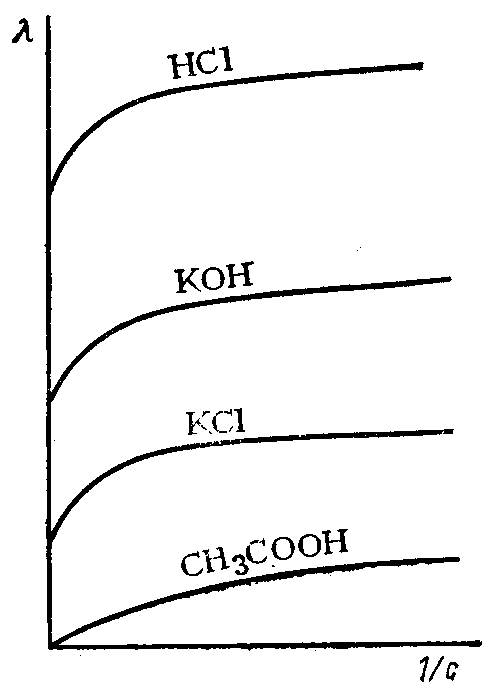
Рис. 84. Зависимость эквивалентной электропроводности растворов электролитов от степени разбавления
В таких условиях в растворах сильных электролитов ионы находятся на достаточно больших расстояниях друг от друга, электростатические взаимодействия между ними отсутствуют, ионные атмосферы не образуются.
В растворах слабых электролитов степень диссоциации достигает своей максимальной величины (a = 1) и все молекулы распадаются на ионы.
Следовательно, λ∞ в таких условиях зависит только от скорости движения ионов.
Кольрауш установил, что при таком разведении катионы и анионы проводят электричество независимо друг от друга, т.к. силы взаимодействия между ними отсутствуют. В этом случае эквивалентная электропроводность раствора будет равна сумме электропроводностей катионов (λк) и анионов (λа)
λ∞ = λк + λа
Дата публикования: 2014-11-03; Прочитано: 7025 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
