 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Неорганические катализаторы
|
|
Установлено, что ионы меди и железа (Cu+, Cu+2, Fe+2, Fe+3) являются катализаторами окислительных реакций в вине. Французскими учеными - Женевуа и Ж.Риберо-Гайоном и А.К.Родопуло показано, что комплексно связанные ионы железа являются более сильными катализаторами, чем неорганические соли железа. Установлено, что таким мощным катализатором является комплексная соль железа и винной кислоты:
СОО
 |  | ||
 СНОН
СНОН
 Fe
Fe
 СНОН
СНОН
СОО
В комплексных солях переход из 2-х валентного железа в 3-х валентное и наоборот является обратимым, что обусловливает высокую эффективность данной системы. Существуют несколько теорий по механизму действия неорагнических катализаторов. наиболее вероятной является теория, согласно которой комплексно связанные соли тяжелых металлов образуют соединения с субстратом окисления, активируют газообразный кислород, присоединяясь к нему, при этом получается отрицательно заряженный кислород, который активно окисляет субстрат.
По данным А.П.Баха молекула кислорода непосредственно с водородом связываться не может. Вначале он должен вступить в реакцию с ненасыщенными веществами, которые он назвал оксигеназами. При этой реакции образуются вещества типа пероксидов, где кислород находится в активном состоянии:



 R1-CH=CH-R2 + O2 R1-CH-CH-R2 + R3H2 R3O +H2O + R1-CH=CH-R2
R1-CH=CH-R2 + O2 R1-CH-CH-R2 + R3H2 R3O +H2O + R1-CH=CH-R2
O---O оксид
перекись
Далее перекись передает кислород какому-то веществу, при этом образуется оксид, вода и регенерируется оксигеназа.
Освобожденная оксигеназа может вновь присоединять кислород и реакция продолжается. такими оксигеназами являются аскорбиновая, фумаровая и диоксифумаровая кислоты, ненасыщенные жирные кислоты (линолевая, линоленовая), терпеноиды, полифенолы и др.
В последнее время в химических и биохимичесикх процессах, и в частности, в ОВ-процессах, особое значение придают анион-радикалу О2- (часто его называют супероксидом), который образуется при одноэлектронном восстановлении молекулярного кислорода и при энзиматическом аэробном метаболизме. Механизм образования О2- следующий:
 Fe, Cu + O2 O2 -- - супероксид (обладает очень высокой активностью и вызывает окисление компонентов).
Fe, Cu + O2 O2 -- - супероксид (обладает очень высокой активностью и вызывает окисление компонентов).
 O2-- +RH2 RO + H2O
O2-- +RH2 RO + H2O
Кроме того, возможно взаимодействие данного анион-радикала непосредственно с Н2О2, в результате чего образуется гидроксильный анион-радикал:
 О2- + Н2О2 О2- + ОН- + ОН*.
О2- + Н2О2 О2- + ОН- + ОН*.
ОВ-системы сусла и вина
Процессы окисления и восстановления в вине являются сопряженными, т.е. одно вещество окисляется, отдает атомы водорода, при этом одновременно другое вещество восстанавливается:
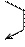
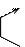
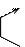


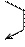
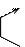 A BH2 C Z
A BH2 C Z
 O2*
O2*
AH2 B CH2....... ZH2
O2*- окисляет в первую очередь те вещества, которые имеют высокий ОВ-потенциал. При этом расходуются самые восстановленные вещества - редуктоны. Если требуется получить неокисленные вина (белые, столовые, шампанские), следует, чтобы в вине содержалось большое количество редуктонов (аскорбновая кислота). Следует также отметить, что терпеноиды играют в вине роль антиокислителей, т.к. содержат двойные связи.
По современным представлениям окисление и восстановление сопровождается переносом электронов. Интенсивность ОВ-процессов в вине характеризуется ОВ-потенциалом (редокс-потенциал), который зависит от соотношения ОВ-систем в вине.
В вине содержатся обратимые и необратимые ОВ-системы. При доступе кислорода равновесие реакции сдвигается в сторону окисленных форм, при анаэробной выдержке - в сторону восстановленных форм. Наличие дрожжей в вине способствует усилению восстановительных процессов. По мнению ряда ученых, это связано с проходом из дрожжевых клеток восстановителей (глютатиона, цистеина и др.). Важное значение имеют ферменты дрожжей, особенно дегидрогеназы, которые ускоряют реакции восстановления окисленных соединений. Созревание различных типов вин должно протекать при определенном уровне ОВ-потенциала. Наиболее важными ОВ-системами являются следующие:
1. Обратимые системы
1.


 СООН СООН СООН
СООН СООН СООН



 СНОН -2Н С-ОН -2Н С=О +О2 СООН
СНОН -2Н С-ОН -2Н С=О +О2 СООН




 -2СО2
-2СО2


 СНОН +2Н С-ОН +2Н С=О СООН
СНОН +2Н С-ОН +2Н С=О СООН
Дата публикования: 2014-11-02; Прочитано: 1224 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
