 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Введение. Любая химическая реакция протекает во времени
|
|
Любая химическая реакция протекает во времени. Некоторые реакции заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни; известны реакции, требующие для своего протекания нескольких лет, десятилетий и большего времени. Кроме того, одна и та же реакция может в одних условиях, например при повышенных температурах, протекать быстро, а в других - например при охлаждении, - медленно.
Интенсивность протекания процесса характеризует скорость химической реакции, которая зависит от многих факторов.
На скорость реакции влияют:
· природа реагирующих веществ;
· реакционная среда;
· концентрации реагентов;
· давление;
· температура;
· присутствие в системе катализаторов;
· размер поверхности раздела (гетерогенные системы);
· внешние воздействия, например, излучения и др.
Весьма важно не только знать, с какой скоростью будет протекать реакция в тех или иных условиях, но и как нужно изменить эти условия для того, чтобы реакция протекала с требуемой скоростью.
Раздел химии, изучающий скорости и механизмы химических реакций, называется химической кинетикой.
Основные понятия химической кинетики
Различают гомогенные и гетерогенные химические реакции. Гомогенной называется реакция, протекающая в одной фазе. Гомогенная реакция осуществляется во всем объеме системы (в газовой фазе или жидком растворе), например:
H2 (г) + I2 (г) ®2 HI (г)
HCl (р-р) + NaOH (р-р) ®NaCl (р-р) + H2O (ж).
Гетерогенной называется реакция, протекающая на границе раздела фаз (твердой и жидкой, твердой и газообразной),например:
Fe (тв) + 2 HCl (р-р) ®Fe Cl2 (р-р) + H2 (г)
FeO (тв) + H2 (г) 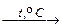 Fe (тв) + H2O (г).
Fe (тв) + H2O (г).
Все реакции подразделяют на простые и сложные.
Простой (элементарной) называется реакция, протекающая в одну стадию (элементарный акт).
Количество частиц (молекул, атомов, ионов), принимающих участие в элементарной реакции, определяет ее молекулярность.
Мономолекулярная реакция - реакция с участием одной частицы. Например, реакция, связанная с распадом молекулы:
H2 ® 2H
SO2Cl2 ® SO2 + Cl2.
Бимолекулярная реакция – реакция, протекающая в результате взаимодействия в элементарном акте двух молекул:
H2 + I 2 ® 2HI
2NO ® N2O2.
Тримолекулярные реакции – реакции, требующие одновременного столкновения трех частиц:
2NO + H2 ® N2O + H2O.
Чаще всего встречаются мономолекулярные и бимолекулярные реакции. Реакции с молекулярностью больше трех неизвестны, что связано с крайне малой вероятностью одновременного столкновения четырех и более частиц.
Большинство химических реакций являются сложными.
Сложные реакции – это многостадийные реакции, протекающие через ряд элементарных (простых) реакций.
К сложным реакциям относятся последовательные, параллельные, цепные, фотохимические и некоторые другие реакции.
В последовательных реакциях
A  B
B  C
C
продукт, образованный в предыдущей стадии, является одновременно исходным веществом для последующей стадии. Общая скорость процесса определяется скоростью наиболее медленной стадии, которая называется лимитирующей.
В параллельных реакциях исходные вещества претерпевают превращение одновременно в двух или нескольких направлениях по следующей схеме:
 В
В
 A
A
D
Общая скорость процесса определяется скоростью наиболее быстрой стадии.
Совокупность элементарных реакций, из которых складывается сложная химическая реакция, называется механизмом реакции.
Дата публикования: 2014-11-02; Прочитано: 346 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
