 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика химических реакций
|
|
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени и зависит от концентрации реагирующих веществ. Эта зависимость при равных концентрациях всех реагирующих веществ выражается уравнением:
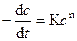 , (1)
, (1)
где  – скорость реакции; с – концентрация любого из вступающих в реакцию веществ; t – время, отсчитываемое от начала реакции; K – константа скорости реакции; n – порядок реакции.
– скорость реакции; с – концентрация любого из вступающих в реакцию веществ; t – время, отсчитываемое от начала реакции; K – константа скорости реакции; n – порядок реакции.
Если n = 1, то реакция называется реакцией 1-ого порядка; если n = 2, то реакцией 2-го порядка и т.д.
Для реакций 1-го порядка уравнение (1) принимает вид
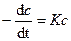 .
.
После интегрирования получим
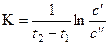 , (2)
, (2)
где 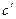 и
и 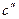 – концентрации исходного вещества в моменты времени t1 и t2.
– концентрации исходного вещества в моменты времени t1 и t2.
Как видно из уравнения (2), числовое значение константы скорости не зависит от способа выражения концентрации, следовательно, отношение концентраций может быть заменено равным ему отношением пропорциональных концентрациям величин.
Для реакции 2-го порядка имеем
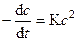 ;
;
после интегрирования
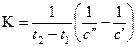 , (3)
, (3)
при t = 0
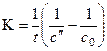 ,
,
где с 0 – начальная концентрация исходных веществ; с – концентрация исходных веществ в момент времени t.
Если концентрации реагирующих веществ неодинаковы, то скорость реакции 2-го порядка выражается уравнением
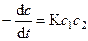 , (4)
, (4)
где с 1 и с 2 – концентрации двух реагирующих веществ, вступивших в реакцию равным числом моль.
Для интегрирования уравнения (4) введем новую переменную x, равную числу моль первого (или второго) вещества, вступившего в реакцию к моменту времени t.
Если объем реакционной смеси V постоянен, число моль первого вещества до начала реакции равно a, число моль второго вещества равно b, то в момент времени t имеем
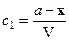
и
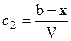 .
.
Подставив значения C1 и С2 в уравнение (4), получим:
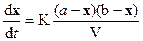 ,
,
или при V = 1
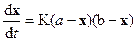 . (5)
. (5)
Проинтегрировав уравнение (5) и решив его относительно K, запишем:
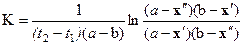 , (6)
, (6)
где 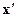 и
и 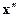 - число моль первого (или второго) вещества, прореагировавшего к моментам t1 и t 2 соответственно.
- число моль первого (или второго) вещества, прореагировавшего к моментам t1 и t 2 соответственно.
Скорость реакции, а, следовательно, и константа скорости быстро возрастают с повышением температуры.
Количественно зависимость между константой скорости и температурой выражается уравнением
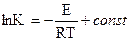 ,
,
или
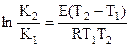 , (7)
, (7)
где T1 и T2 – абсолютные температуры; K1 и K2 – соответствующие этим температурам константы скорости; E – энергия активации, т.е. та минимальная энергия, рассчитанная на 1 моль, которую должны приобрести молекулы реагирующих веществ, чтобы при столкновении они могли вступить во взаимодействие.
ЛАБОРАТОРНАЯ РАБОТА № 6
Дата публикования: 2015-11-01; Прочитано: 262 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
