 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электропроводность электролитов
|
|
Способность электролитов проводить электрический ток характеризуется сопротивлением или электропроводностью. Сопротивление проводника R (Ом) пропорционально его длине l (см) и обратно пропорционально поперечному сечению S (см2):
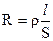 (1)
(1)
где r - удельное сопротивление, зависящее от природы проводника и температуры. Величина, обратная удельному сопротивлению, называется удельной электропроводностью, обозначается æ и определяется проводимостью столбика раствора электролита длиной 1 см и сечением 1 см2. При этом размерность удельной электропроводности  . Тогда согласно определению r =1/ æ, следовательно,
. Тогда согласно определению r =1/ æ, следовательно,
R = 1 /S æ
и (2)
æ 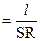 .
.
Для характеристики раствора электролита, кроме удельной электропроводности, большое значение имеет так называемая эквивалентная электропроводность l, связанная с удельной соотношением:
l = (æ/c) 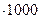 , (3)
, (3)
где c – концентрация электролита, выраженная в г-экв/л. Эквивалентная электропроводность численно равна электропроводности такого объема раствора, который содержит 1 г-экв электролита и помещен между параллельными электродами, отстоящими друг от друга на расстоянии 1 см. Эквивалентная электропроводность слабого
электролита связана с подвижностью ионов и степенью диссоциации уравнением:
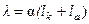 (4)
(4)
где a - степень диссоциации; lk – подвижность катиона; la – подвижность аниона. При бесконечном разведении степень диссоциации возрастает, приближаясь к 1. Одновременно возрастает и эквивалентная проводимость, достигая предельного значения l 0 в бесконечно разбавленном растворе:
l 0 = lk + la. (5)
Сравнивая (4) и (5), получаем a =  . Константа диссоциации слабого бинарного одновалентного электролита, например уксусной кислоты, может быть найдена таким образом:
. Константа диссоциации слабого бинарного одновалентного электролита, например уксусной кислоты, может быть найдена таким образом:
HA Û H+ + A-, 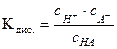 . (6)
. (6)
Если c – концентрация электролита, a - степень диссоциации, то равновесные концентрации будут иметь следующие значения:
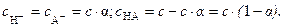
Подставляя эти значения в (6), получаем:
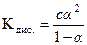 .
.
Зная, что a =  , имеем выражение для константы диссоциации:
, имеем выражение для константы диссоциации:
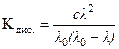 . (7)
. (7)
Для вычисления электропроводности по уравнению (2) необходимо опытным путем найти сопротивления R и отношение l /S. Последнее зависит лишь от формы и размеров электродов, их относительного расположения, но не от природы электролита и концентрации, т.е. является
константой сосуда, в котором производятся измерения (постоянная электролитической ячейки).
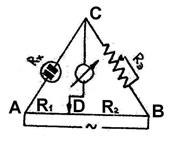 Для определения сопротивления исследуемый раствор наливают в сосуд с двумя платиновыми электродами, покрытыми платиновой чернью. Измерение сопротивления R слоя электролита, заключенного между электродами, осуществляется путем сравнения этого неизвестного сопротивления с известным с помощью мостика Кольрауша, где AB – измерительная проволока; R1 и R2 – плечи мостика; Rэ – магазин сопротивлений (известное сопротивление); Rх – сопротивление сосуда с раствором электролита.
Для определения сопротивления исследуемый раствор наливают в сосуд с двумя платиновыми электродами, покрытыми платиновой чернью. Измерение сопротивления R слоя электролита, заключенного между электродами, осуществляется путем сравнения этого неизвестного сопротивления с известным с помощью мостика Кольрауша, где AB – измерительная проволока; R1 и R2 – плечи мостика; Rэ – магазин сопротивлений (известное сопротивление); Rх – сопротивление сосуда с раствором электролита.
Изменяя сопротивление Rэ и передвигая контакт D, находят для него такое положение, при котором нуль-индикатор показывает отсутствие тока. Этому положению контакта соответствует равенство отношений Rх/Rэ и R1/R2, т.е. на участке CD не будет проходить ток, если выполняется равенство
 .
.
На практике часто применяют более удобный в обращении мост Р-38. Сосуд (электролитическая ячейка) с платиновыми электродами, наполненный электролитом, присоединяют к контактам Rх. Правила обращения с мостом Р-38 приведены на внутренней стороне крышки прибора.
Цель работы – установление зависимости удельной и эквивалентной электропроводности уксусной кислоты от концентрации, определение константы диссоциации последней.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
При всех измерениях электропроводности первоначально находят константу сосуда l /S по измерению сопротивления раствора электролита-эталона, удельная электропроводность которого известна в широком интервале концентраций и температур. Обычно для этой цели используют раствор хлорида калия. Сосуд для измерения электропроводности ополаскивают дистиллированной водой и 2-3 раза исследуемым раствором. Затем наливают такое количество раствора, чтобы уровень жидкости превышал на 3-5 мм верхний край электродов. При всех измерениях объем жидкости в сосуде должен быть одним и тем же, поэтому наполнять сосуд следует с помощью мерного цилиндра. Наливают 50 мл 0,001 н. раствора хлорида калия и измеряют его сопротивление R, взяв среднее значение из трех определений. По уравнению (2) находят величину l /S:
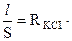 æ KCI
æ KCI
Зависимость удельной электропроводности 0,001 н. раствора KCI от температуры приведена в таблице:
| t, °C | |||
æ, 
| 0,000127 | 0,000133 | 0,0001473 |
Зная константу сосуда, можно определять удельную и эквивалентную электропроводности любого электролита.
Для выполнения работы в сосуд для измерения электропроводности наливают 50 мл 1н. уксусной кислоты и определяют сопротивление раствора, взяв среднее из трех значений. Закончив измерения с 1н. раствором, отбирают 25 мл этого раствора и добавляют 25 мл воды к оставшимся 25 мл 1 н. раствора уксусной кислоты. Полученный разбавлением 0,5 н. раствор взбалтывают и снова измеряют сопротивление, как указано выше. Подобное последовательное разбавление повторяют еще три раза, получая 0,25; 0,125; 0,0625 н. растворов уксусной кислоты и соответственно измеряя их сопротивление. По формулам (2) и (3) рассчитывают удельную и эквивалентную электропроводности, а по уравнению (7) – константу диссоциации уксусной кислоты для приведенных значений концентраций. Величину предельной эквивалентной электропроводности (l0) уксусной кислоты вычисляют по уравнению (5), подставив вместо l k подвижность иона водорода:
l H+ = 315(1 + 0,0154(t –18)),
а вместо la – подвижность аниона уксусной кислоты:
 = 35,5(1 + 0,0236(t – 18)),
= 35,5(1 + 0,0236(t – 18)),
где t – температура опыта, °C.
Вычисленная константа диссоциации несколько изменяется с концентрацией. Полностью независимой от концентрации является константа диссоциации, выраженная через активность (Ka).
Результаты измерений и вычислений представляют в виде сводной таблицы и двух кривых, изображающих зависимость:
1) удельной электропроводности от концентрации;
2) эквивалентной электропроводности от концентрации.
ЛАБОРАТОРНАЯ РАБОТА № 4
Дата публикования: 2015-11-01; Прочитано: 642 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
