 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы проведения микробиологических испытаний
|
|
Определение количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (ГОСТ 10444.15-94)
Отбор и подготовка пробы – по ГОСТ 26668.
Для определения обсемененности продукта бактериями чашечным методом (методом предельных разведений) взвешивают стерильную ступку со стерильным песком, во взвешенную ступку помещают навеску продукта около 10 г, взвешивают еще раз, по разнице весов определяют взятую навеску. Навеску тщательно растирают с песком, соблюдая правила асептики, допустимо приливать в ступку немного стерильной воды из колбы, приготовленной для разведения. Растертый продукт переносят в колбу, содержащую 90 мл стерильной воды. Колбу с навеской тщательно размешивают 10-15 минут, дают смеси осесть и выполняют разведение материала в 102, 103,104 раз. Стерильной пипеткой по 1 мм соответствующего разведения перенося в стерильные чашки Петри, заливают остуженным до 450С РПА, пишут данные об анализе на крышке чашки, после застывания агара чашку помещают донышком кверху в термостат. Посев термостатируют 18-24 часа при температуре 370С. Результаты оценивают по каждой пробе отдельно. Для подсчета количества микроорганизмов учитывают все выросшие колонии. Подсчет проводят в посевах разведения, в котором количество колоний составляет 30 – 300. По результатам подсчета вычисляют среднее арифметическое значение количества колоний из всех посевов одного разведения.
Количество микроорганизмов в 1 г продукта рассчитывается по формуле:
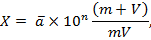
Где 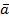 – среднее арифметическое количество колоний в посевах; n – число 10-кратных разведений навески продукта; m – масса навески продукта, взятая для приготовления исходного разведения, г; V – объем жидкости, взятый для приготовления исходного разведения навески продукта, г.
– среднее арифметическое количество колоний в посевах; n – число 10-кратных разведений навески продукта; m – масса навески продукта, взятая для приготовления исходного разведения, г; V – объем жидкости, взятый для приготовления исходного разведения навески продукта, г.
Результаты вычисления количества микроорганизмов в 1 г продукта выражают числом колониеобразующих единиц (КОЕ) от 1,0 до 9,9, умноженным на  .
.
Выявление бактерий группы кишечных палочек (колиформных бактерий) (ГОСТ Р 52816-2007)
Метод выявления основан на высеве определенного количества продукта в жидкие лактозосодержащие среды (среду Кесслер), инкубировании посевов при 37 ± 1оС в течение 48 ± 3 ч, подтверждении принадлежности выросших микроорганизмов по сбраживанию лактозы с образованием кислоты и газа и морфологическими признаками к бактериям группы кишечных палочек.
Посевы, предназначенные для выявления БГКП, предварительно просматривают через сутки выдержки в термостате и для дальнейших исследований отбирают пробирки с помутневшей средой, изменившей цвет с фиолетового на жело-зеленый, с наличием пузырьков газа в поплавках. Окончательный учет проводят через 48 ч.
Подтверждение принадлежности выросших на среде Кесслера микроорганизмов к БГКП осуществляют по культурально-морфологическим особенностям. С этой целью из жидкой питательной среды проводят пересев на поверхность среды Эндо таким образом, чтобы изолировать рост. БГКП через 24 ч инкубирования посевов при 37 ± 1оС образуют красные, розовые колонии с металлическим блеском или без него.
Не мене чем из 5 колоний готовят мазки с окрашиванием по Граму: бактерии этой группы – грамотрицательные, неспорообразующие палочки.
Результаты считают положительными при обнаружении с признаками БГКП. Для выявления БГКП допускается использование других жидких лакозообразующих сред (Хейфеца или бульона лактозного с бриллиантовым зеленым и желчью). Цвет среды Хейфеца при росте БГКП переходит из красно-фиолетового в зеленый.
Для проведения пересевов допускается использование среды Левина. БГКП на этой среде образуют блестящие черные или темные с черным центром либо сиреневые с черным центром колонии.
Метод определения количества БГКП посевом в агаризованные дифференциальные среды (среда Эндо, Левина) предназначен для отбора проб, в 1 г продукта которых содержится более 150 КОЕ этих микроорганизмов. На поверхности среды в двух чашках наносят по 0,1 – 0,2 см3 разведения продукта, немедленно растирают шпателем и подсушивают для предотвращения конденсации влаги. Посевы помещают в термостат при 37 ± 1оС на 24 ± 3 ч. Для подсчета отбирают чашки, на которых выросло от 15 до 150 характерных колоний. Для идентификации не менее чем из 5 колоний проводят пересев на жидкие лактозообразующие среды и изучают морфологию в мазках, окрашенных по Граму.
Выявление бактерий р. Salmonella (ГОСТ Р 52814-2007)
Среднюю навеску продукта массой 25 г отбирают в стерильную емкость, измельчают и помещают в среду обогащения Мюллера или селенитовый бульон. Соотношение навески и среды должно быть 1:5. Посевы термостатируют 18-20 часов при температуре 370С. Если среда замутится, то из нее петлей производят посев на поверхность элективных питательных сред ВСА, Эндо, Левина или Плоскирева в чашках Петри. Посевы инкубируют на среде ВСА 48 часов, на остальных 18-24 часа при температуре 370С
Сальмонеллы на средах Эндо и Плоскирева растут в виде бесцветных колоний, на среде Левина – голубоватых, на ВСА – обычно в виде черных колоний с металлическим блеском и окрашиванием среды под колониями в черный цвет.
Биохимические свойства культуры определяют путем изучения не менее 5 подозрительных колоний, выросших на дифференциальной среде. Определяют расщепление сахаров, лактозы, глюкозы, сахарозы, маннита, мочевины, образование индола, сероводорода, ацетилметилкарбинола (реакция Фогес-Проскауэра), утилизацию цитрата, расщепление аминокислот.
Для выявления ферментации сахаров используют среды Гисса, либо одну из комбинированных сред (Клиглера, Ресселя, агар трехсахарный). С этой целью часть каждой из пяти отобранных подозрительных колоний снимают бактериологической петлей, размешивают в 0,5 – 1 см3 стерильного физиологического раствора и вносят в среды Гисса. Инкубируют при 37±10С в течении 12 – 18 ч, после чего посевы просматривают. При образовании кислоты цвет среды меняется. При ферментировании лактозы, сахарозы в скошенный части столбика комбинированных сред наблюдается пожелтение. Покраснение или пожелтение самого столбика указывает на расщепление глюкозы. Сальмонеллы не разлагают лактозу и сахарозу, ферментируют глюкозу с образованием кислоты и газа, а манит – с образованием кислоты.
Для выявления ферментации мочевины используют агар трехсахарный или скошенный агар с мочевиной. Посевы на этих средах выдерживают в термостате 37±10С в течение 24 ч. Восстановление изменившегося цвета трехсахарного агара при расщеплении глюкозы с красного или желтого до бледно-розового свидетельствует о расщеплении мочевины. В посевах на скошенный агар с мочевиной окрашивание среды в красный цвет свидетельствует о положительной реакции, отсутствие окраски – об отрицательной.
Для выявления образования сероводорода используют трехсахарный агар, среду Клиглера или 1%-ную пептонную воду. Посевы инкубируют при 37±10С в течение 24 – 72 ч. об образовании сероводорода в комбинированных среда судят по почернению среды в столбике.
Серологические реакции проводят с суточной агаровой культурой. Вначале ставят контроль на самоагглютинацию. С этой целью на предметное стекло наносят каплю физиологического раствора и растирают в ней некоторое количество исследуемой культуры до получения однородной мутной суспензии. Стекло покачивают в течение 30 – 40 с, затем помещают его на темный фон и рассматривают. При агглютинации образуются хлопья, комочки. Самоагглютинирующие культуры серологическому подтверждению не подлежат.
Серологическую типизацию проводят постановкой РА на стекле вначале с поливалентной О-сывороткой. При получении положительной реакции культуру испытывают с сыворотками к антигенам отдельных О-групп, входящих в поливалентные сыворотки, затем выявляют Vi- и Г-антигены. Для выявления Vi-антигена исследуемую культуру испытывают с моновалентной Vi-сывороткой; Н-антигеной – с моновалентными Н-сыворотками. Для выявления Н-антигена в РА следует использовать культуру с нижней, более влажной части агара. К бактериям рода сальмонелл относят культуры, не ферментирующие лактозу, сахарозу, расщепляющие глюкозу и манит, образующие сероводород и не образующие индол, утилизирующие цитрат и не расщепляющие мочевину.
Выявление коагулазоположительного стафилококка (ГОСТ Р 52815-2007)
Стерильно готовят 10% взвесь исходного материала в РПБ с 6,5% хлористого натрия. Посев термостатируют 24 часа при температуре 370С. После термостатирования материал высевают биологической петлей на МСА и ЖСА. Посевы проращивают при температуре 370С 48 часов. Патогенные стафилококки на желточно-солевом агаре образуют вокруг колоний зону плотного коагулянта – «радужный венчик» (лецитинвителазная реакция). Из колоний, окрашенных в золотисто-желтый, лимонный, фарфорово-белый цвета делают мазки и окрашивают по Граму. При обнаружении в мазках Грамположительных стафилококков, культуру отсевают на косой РПА и инкубируют при 370С 18-24 часа.
Одновременно с окраской по Граму определяют способность культуры образовывать каталазу. На колонию наносят 3% раствор перекиси водорода и прикрывают стерильным покровным стеклом. Стафилококки имеют положительную реакцию на каталазу: они расщепляют перекись водорода на воду и атомарный кислород, который хорошо виден под стеклом в виде пузырьков.
С чистым материалом со скошенного агара выполняют реакцию плазмокоагуляции: в пробирку с 0,5 мл стерильной плазмы крови кролика вносят 1 петлю чистой культуры стафилококка, одну пробирку оставляют для контроля. Посевы термостатируют при370С 3-6 часов, если плазма не свернулась за 6 часов, пробирки оставляют на 24 часа при комнатной температуре. Если плазма свернется, реакция считается положительной, а стафилококк – патогенным. (Скоагулированная плазма не выпадает из пробирки при переворачивании).
Выявление дрожжей и плесневых грибов (ГОСТ 10444.12-88)
Из подготовленной пробы продукта и его разведения 1 мл материала высевают в 2 чашки Петри, посевы заливают питательной средой Сабуро. Посевы термостатируют 5 суток при температуре 24 С.
Развитие дрожжей на агаризованных средах сопровождается образованием крупных выпуклых блестящих серовато-белых, белых, розовых колоний с гладким ровным краем. Плесневые грибы дают на средах пушистые, волокнистые колонии, окрашенные в разные цвета. Микроскопические грибы определяют в живой культуре по определителю микроскопических грибов [14].
Предельно допустимые микробиологические показатели безопасности представлены в таблице 2 [1].
Таблица 3 - Предельно допустимые микробиологические показатели безопасности [1]
Дата публикования: 2015-11-01; Прочитано: 1866 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
