 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
FЭ (формульная единица вещества) ≡эквивалент
|
|
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH ® K3PO4 + 3H2O fЭ(H3PO4) = 1/3
H3PO4 + KOH ® KН2PO4 + H2O fЭ(H3PO4) = 1.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Эквивалент оксида, основания, кислоты и соли:
Эоксида = Mоксида /(число атомов элемента х валентность элемента);
Эоснования = Моснования / кислотность основания;
Экислоты = Мкислоты / основность кислоты;
Эсоли = Мсоли /(число атомов металла х валентность металла), где М— мольная масса соединений.
Например, Э(А12О3) = 102/(2x3) = 17; Э(А1(ОН)3) = 78/3 = 26; Э(Н2S04) = 98/2 = 49; Э(А12(SО4)3) =342 /(2x3) = 57
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
25)Коррозия металлов. Классификация коррозийных процессов.
Коррозия- самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика,дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде:
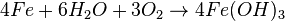
Гидроксид железа Fe(OН)3 и является тем, что называют ржавчиной.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней средой; по виду коррозионной среды и условиям протекания процесса; по характеру коррозионных разрушений; по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
26)Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов.
Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Блуждающие токи или токи, рассеянные в проводящей среде, возникают в результате различных природных явлений или создаются промышленными электрическим установками, использующими проводящею среду (землю, морскую воду) в качестве токопровода.
Источниками естественных блуждающих токов являются вариации магнитного поля Земли, грозовые разряды, перемещения земных пород и другие природные явления. Максимальная напряженность естественных электрических полей не превышает 150мВ/км, поэтому очевидно, что они не представляют практической коррозионной опасности.
Промышленные блуждающие токи создаются линиями электротранспорта, заземлителями постоянного тока, системами катодной защиты и другими электрическими установками. Они могут быть очень значительными по величине и наносить серьезный ущерб металлическим сооружениям, находящимся в зоне их действия.
Интенсивность коррозии объектов в поле блуждающих токов определяется напряженностью поля, удельным сопротивлением среды, состоянием изоляционного покрытия объекта, взаимным расположением объекта и источника тока.
27)Защитные покрытия(катодные, анодные, металлические, неметаллические, химические).
Металлические защитные покрытия наносятся на поверхности (металл, стекло, керамика, пластмассы и др.) для защиты их от коррозии, придания твердости, электропроводности, износостойкости и в декоративных целях.
По способу защиты металлические защитные покрытия разделяют на катодные и анодные. Характер такой защиты от коррозии обусловлен тем, что металлопокрытие, по отношению к покрываемому изделию, может быть анодом или катодом (зависит от электрохимической характеристики металла покрытия).Электрохимическую защиту от коррозии осуществляют только анодные покрытия. На поверхности защищаемого изделия, при наличии влаги в окружающей среде, образуются замкнутый гальванический элемент. Металл с более электроотрицательным электрохимическим потенциалом (покрытие) будет играть роль анода, при этом подложка - катод.Вследствии работы гальванического элемента металл, являющийся анодом, будет под воздействием окружающей среды постепенно разрушаться, этим самым защищая изделие.При защите от коррозии с помощью анодных покрытий важным аспектом можно считать то, что металлопокрытие будет защитным даже при наличии на нем пор и царапин. Хорошим примером анодного покрытия является цинковое покрытие не железе.Защита от коррозии катодными покрытиями осуществляется реже, так как катодное покрытие защищает изделие лишь механически. Катодное защитное покрытие имеет более положительный электродный потенциал. При этом основной металл изделия является анодом и при подводе к нему влаги начнется интенсивное его растворение. Именно поэтому катодное покрытие должно быть сплошным, без малейших признаков пор и, желательно, равномерное, относительно большой толщины. Примером катодного покрытия служит оловянный или медный сплошный слой на железе.
Неметаллические защитные покрытия применяются для изоляции металлических изделий, их защиты от воздействия внешней среды (влаги), придания красивого вида.Неметаллические защитные покрытия принято разделять на лакокрасочные, полимерные, покрытия резинами, смазками, силикатными эмалями, пастами.
28)Воздействие на среду с целью снижения ее коррозийной активности.
Наиболее агрессивные среды – вода и почва. Снижение коррозионной угрозы для стали, железа, латуни заключается в удалении растворённых в воде O2 и СО2. Физически это осуществляется продувкой инертным газом, химически – обработкой восстановителем или пропусканием через слой стальных стружек. Так же зачастую требуется очистить воду от возбудителей локальной коррозии, например, хлоридов. Так же добавляют небольшие объёмы ингибиторов коррозии, соединений, которые её замедляют (фосфаты, силикаты, бензоат натрия – анодные ингибиторы ингибиторы; сульфаты цинка, бикарбонат натрия – катодные ингибиторы). Анодные и катодные ингибиторы эффективнее использовать вместе. Ещё один важный класс ингибиторов – пассиваторы. Они смещают электродный потенциал металла в положительную область и таким образом делают его пассивным. Чаще всего это благородные металлы либо окислители пероксидного типа. Если район промышленный, важным фактором при развитии самопроизвольного разрушения металла являются показатели выбросов в среду сажи, SO2,CO2, H2S, NH3 и т.п. Самый опасный из них – SO2. На поверхности металла под воздействием влажной среды он переходит в серную кислоту. Единственный способ снижения агрессивности такой среды – устранение выбросов, очистка воздуха.
29)Изменение состава или структуры металла, ведущие к повышению их коррозийной стойкости.
Леги́рование — добавление в состав материалов примесей для изменения (улучшения) физических и/или химических свойств основного материала. Легирование является обобщающим понятием ряда технологических процедур, различают объёмное (металлургическое) и поверхностное (ионное, диффузное и др.) легирование.
В разных отраслях применяются разные технологии легирования.
В металлургии легирование производится в основном введением в расплав или шихту дополнительных веществ (например, в сталь — хрома, никеля, молибдена), улучшающих механические, физические и химические свойства сплава. Для изменения различных свойств (повышения твёрдости, износостойкости, коррозионной стойкости и т. д.) приповерхностного слоя металлов и сплавов применяются также и разные виды поверхностного легирования. Легирование проводится на различных этапах получения металлического материала с целями повышения качества металлургической продукции и металлических изделий.
30)Электрохимическая защита: протекторная, катодная, анодная, электродренажная.
Электрохимическая защита основана на том, что, сдвигая потенциал металла пропусканием внешнего тока, можно изменять скорость его коррозии. Однако для наиболее распространенного вида коррозии металлов с кислородной деполяризацией в условиях ограниченного доступа кислорода наложение внешнего катодного тока эффективно для предотвращения коррозии.
Катодная защита
Электрохимическая защита, основанная на наложении катодного тока, носит название катодной. Она реализуется в производственных условиях в двух вариантах. В первом необходимый сдвиг потенциала обеспечивается подключением защищаемого изделия в качестве катода к внешнему источнику тока. В качестве анода используются вспомогательные инертные электроды. Так защищают буровые платформы, сварные металлические основания, подземные трубопроводы.
Дата публикования: 2015-11-01; Прочитано: 775 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
