 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Использование радиоактивных изотопов и ионизирующих излучений для диагностики и лечения болезней
|
|
Радиоактивные изотопы и ионизирующие излучения для диагностики и лечения широко применяются в медицине, а в ветеринарии для практического использования они не нашли широкого применения.
Радиоактивные изотопы, используемые для диагностики должны отвечать следующим требованиям: иметь короткий период полураспада, низкую радиотоксичность, возможность для регистрации их излучений, а также накапливаться в тканях обследуемого органа. Например, для диагностики патологических состояний костной ткани используют 67Ga (галий), для диагностики первичных и вторичных опухолей скелета – изотопы стронция (85Sr и 87Sr), для диагностики печени – 99Tc и 113In (технеций и индий) для диагностики почек – 131I (йода) и щитовидной железы 24Na (натрия) и131I (йода), селезенки – 53Fe (железа) и 52Cr (хрома).
Радиоактивные изотопы используют для определения функционального состояния сердечно-сосудистой системы по скорости кровотока и объему циркулирующей крови. Метод основан на регистрации перемещения меченной гамма-радиоактивной меткой крови в сердце и в разных участках сосудов. Радиоизотопные методы позволяют определять минутный объем крови в сердце и объем крови, циркулирующей в сосудах, в тканях органов. С помощью радиоактивных газов, из которых чаще используется радиоизотоп ксенона (133Хе), определяют функциональное состояние внешнего дыхания – вентиляции, диффузии в легочном кровотоке.
Изотопный метод очень эффективен при исследовании водного обмена, как в норме, так и при нарушении обмена веществ, инфекционной и неинфекционной патологии. Метод состоит в том, что в состав молекулы водорода (1Н) вводят его радиоактивный изотоп тритий (3Н). Меченую воду в виде инъекций вводят в кровь, с которой тритий быстро разносится по организму и проникает во внеклеточное пространство и клетки, где вступает в реакции обмена с биохимическими молекулами. При этом, прослеживая путь и скорость обменных реакций трития, определяют динамику водного обмена.
При некоторых заболеваниях крови возникает необходимость исследования функций селезенки, для этих целей используют радиоизотоп железа (59Fe). Радиоактивное железо вводят в кровь в виде метки в составе эритроцитов или плазмы, из которых оно поглощается селезенкой, пропорционально функциональному нарушению органа. Концентрация 59Fe в селезенке определяется путем регистрации гамма-излучения, сопровождающего радиоактивным распадом ядер 59Fe, с помощью гамма-щупа, приложенного к области селезенки.
Широкое применение в клинической практике получило сканирование исследуемых органов – печени, почек, селезенки, поджелудочной железы и т. д. При помощи этого метода изучают распределение радиоизотопа в исследуемом органе и функциональное состояние органа. Сканирование дает наглядное представление о месте расположения органа, о его размерах и форме. Диффузное распределение радиоактивного вещества позволяет обнаружить в органе участки интенсивного накопления («горячие» очаги) или пониженной концентрации изотопа («холодные» зоны).
Лечебное применение радиоизотопов и ионизирующих излучений основано на их биологическом действии. Известно, что наиболее радиочувствительны молодые, интенсивно делящиеся клетки, к которым также относятся раковые клетки, поэтому радиотерапия оказалась эффективна на злокачественных новообразованиях и болезнях кроветворных органов. В зависимости от локализации опухоли осуществляют внешнее гамма-облучение с помощью гамма-терапевтических установок; накладывают на кожу аппликаторы с радиоактивным калифорнием (252Cf) для контактного действия; вводят непосредственно в опухоль коллоидные растворы радиоактивных препаратов или полые иглы, заполненные радиоизотопами; вводят внутривенно короткоживущие радионуклиды, которые избирательно накапливаются в опухолевых тканях.
Задачей лучевой терапии рака является подавление способности опухолевых клеток к неограниченному размножению. При небольшом размере опухолевого очага эта задача решается путем облучения опухоли дозой, способной очень быстро подавить клоногенную активность всех клеток опухоли. Однако в большинстве случаев при лучевой терапии в зоне облучения неизбежно оказываются не только опухоль, но и окружающие ее здоровые ткани. Часть нормальных тканей подвергается облучению специально с целью подавления роста опухолевых клеток, которые проникают в нормальные ткани.
В лучевой терапии необходимо совершенствование аппаратуры и источников облучения, способных обеспечивать лучшее пространственное распределение дозы между опухолью и окружающими ее тканями. На начальном этапе развития лучевой терапии основной задачей являлось повышение энергии рентгеновского излучения, что позволяло перейти от лечения поверхностно расположенных новообразований к глубоко расположенным в тканях опухолям. Использование кобальтовых гамма-установок позволяет улучшить соотношение глубинной и поверхностной доз. При этом максимум поглощенной дозы распределятся не на поверхности опухоли, как при рентгеновском облучении, а на глубине 3–4 мм. Использование линейных ускорителей электронов позволяет проводить облучение опухоли пучком электронов высоких энергий. Наиболее совершенные установки в настоящее время снабжаются лепестковым коллиматором, который позволяет формировать поле облучения, соответствующее форме опухоли. Более точное пространственное распределение поглощенной дозы между опухолью и окружающими ее нормальными тканями получают используя тяжелые заряженные частицы, к которым относятся протоны, ионы гелия, ионы тяжелых элементов, а также π --мезоны. Кроме технического прогресса лучевой терапии не менее важным является повышение биологической эффективности лечения, которое предполагает проведение исследований по изучению процессов, происходящих в различных тканях при облучении. При ограниченной распространенности опухолевого процесса эффективным методом лечения является облучение опухоли. Вместе с тем, только одна лучевая терапия опухолей менее эффективна. Излечение большей части больных достигается хирургическими, лекарственными и комбинированными методами в совмещении с лучевой терапией. Улучшение результативности лучевых методов лечения простым увеличением доз облучения вызывает резкое возрастание частоты и тяжести лучевых осложнений в нормальных тканях. Преодолеть этот процесс можно, во-первых, путем углубленного изучения процессов, происходящих в тканях в условиях фракционированного облучения, во-вторых, путем изучения факторов, влияющих на радиочувствительность клеток опухолей и нормальных тканей с учетом индивидуальных особенностей больных. Эти обстоятельства требуют разработки новых методов повышения эффективности лучевой терапии, в частности, за счет использования радиомодификаторов и новых режимов фракционирования дозы. Большое влияние на эффективность лучевой терапии оказывает исходная радиоустойчивость раковых клеток, которая значительно изменяется как среди опухолей различного происхождения, так и в пределах одной опухоли. К радиочувствительным новообразованиям принято относить лимфомы, миеломы, семиномы, опухоли головы и шеи. К опухолям с промежуточной радиочувствительностью относят опухоли молочной железы, рак легкого, рак мочевого пузыря. К наиболее радиоустойчивым опухолям относят опухоли нейрогенного происхождения, остеосаркомы, фибросаркомы, рак почки. Низкодифференцированные опухоли более радиочувствительны, чем высокодифференцированные. В настоящее время имеются данные о высокой изменчивости радиочувствительности клеточных линий, полученных из одной и той же опухоли. Причины широкой вариабельности радиочувствительности раковых клеток к облучению остаются невыясненными до настоящего времени.
Важной задачей раковой терапии является разработка методов селективного (избирательного) управления тканевой радио-чувствительности, направленных на повышение радио-чувствительности опухолевых клеток и увеличение радио-устойчивости клеток здоровых тканей. Фактором, значительно увеличивающим радиоустойчивость опухолевых клеток, является гипоксия, возникающая вследствие дисбаланса в скоростях размножения клеток и роста сосудистой сети, питающей эти клетки. Это было доказано на основании того, что радиоустойчивость облученных клеток значительно возрастает при дефиците кислорода или гипоксии, а также на основании того, что развитие гипоксии является логическим следствием неуправляемого роста злокачественных опухолей. Клетки опухоли растут быстрее, питающей их сосудистой сети, поэтому сосудистая сеть опухолевых клеток, по сравнению с сосудистой сетью нормальных клеток, физиологически неполноценна. Плотность капиллярной сети неравномерно распределена по объему опухоли. Делящиеся клетки, расположенные около сосудов, раздвигают капилляры, и на расстоянии 150-200 мкм от них возникают зоны хронической гипоксии, в которые не доходит кислород. Кроме этого неуправляемое деление клеток приводит к периодическому повышению внутриопухолевого давления, из-за которого происходит временное сдавливание отдельных капилляров и прекращение в них микроциркуляции крови, при этом напряжение кислорода (рО2) может падать до нулевых значений, и поэтому наблюдается состояние острой гипоксии. В таких условиях часть наиболее радиочувствительных клеток опухоли погибает, а радиоустойчивые клетки остаются и продолжают деление. Эти клетки называются гипоксическими опухолевыми клетками.
Методы управления тканевой радиочувствительностью при лучевой терапии основаны на различиях в кровоснабжении и кислородных режимах, метаболизме и интенсивности деления клеток опухолей и нормальных тканей. Для повышения радиочувствительности гипоксических опухолевых клеток в качестве сенсибилизатора используется кислород. В 1950 г. английскими учеными был разработан метод оксибарорадиотерапии, при котором на время сеансов лучевой терапии больной помещается в барокамеру, в которой находится кислород под давлением в три атмосферы. В этом случае кислородом насыщается гемоглобин и значительно увеличивается напряжение кислорода, растворенного в плазме крови. Использование этого метода позволило значительно улучшить лечение нескольких видов опухолей, в первую очередь рака шейки матки и новообразований головы и шеи. В настоящее время используется другой метод насыщения клеток кислородом – дыхание карбогеном, смесью кислорода и 3–5 %-ного углекислого газа, которые усиливает легочную вентиляцию за счет стимулирования дыхательного центра. Улучшению лечебного эффекта способствует назначение больным никотинамида – препарата, расширяющего кровеносные сосуды. Большое внимание уделяется разработке химических соединений, обладающих электронакцепторными свойствами, имеющих, как и кислород, не спаренный электрон, благодаря которому обеспечивается высокая реакционная способность. В отличие от кислорода, электронакцепторные сенсибилизаторы не используются клеткой в процессе энергетического метаболизма и поэтому они более эффективны.
Кроме гипоксии в радиационной онкологии используют гипертермию, т. е. кратковременный, в пределах 1 часа, локальный нагрев отдельных участков тела (локальная гипертермия) или нагрев всего тела, за исключением головного мозга до температуры 40– 43,5 0C (общая гипертермия). Такая температура вызывает гибель некоторой части клеток, которая увеличивается в условиях пониженного напряжения кислорода, характерного для гипоксических зон злокачественных новообразований. Гипертермия применяется для лечения только отдельных злокачественных и доброкачественных новообразований (главным образом аденомы простаты). Для достижения более высоких эффектов лечения гипертермию используют в сочетании с лучевой терапией и химиотерапией, при этом гипертермию проводят до или после облучения. Сеансы гипертермии проводят 2–3 раза в неделю, при этом чаще используется прогрев опухоли после сеанса облучения, чтобы обеспечить в опухоли более высокую температуру, чем в нормальных тканях. При высокой температуре в опухолевых клетках синтезируются особые белки (белки теплового шока), которые участвуют в радиационном восстановлении клеток, поэтому часть повреждений в облученных клетках опухоли восстанавливается, а повторное облучение вызывает гибель этих восстановленных клеток и вновь образующихся клеток. Установлено, что одним из факторов усиления эффекта облучения с помощью гипертермии является подавление репарационных способностей раковой клетки.
Экспериментально доказано, что при облучении клеток, нагретых до температуры 42 0С, поражающий эффект зависит от рН клеточной среды, при этом наименьшая гибель клеток наблюдалась при рН = 7,6, а наибольшая – при рН = 7,0 и менее. Для повышения эффективности лечения опухоли, в организм вводят большое количество глюкозы, которую жадно поглощает опухоль и преобразует ее в молочную кислоту, поэтому в клетках опухоли рН снижается до 6 и 5,5. Введение в организм повышенного количества глюкозы также увеличивает в крови содержание сахара в 3–4 раза, поэтому значительно снижается рН и усиливается противоопухолевое действие гипертермии, которое проявляется в массовой гибели клеток.
При разработке методов облучения опухоли встает проблема противолучевой защиты нормальных тканей, поэтому необходимо разрабатывать методы, способствующие повышению радиоустойчивости нормальных тканей, что в свою очередь позволит увеличить дозы облучения опухолей и повысить эффективность лечения. В настоящее время доказано, что в условиях гипоксии лучевое поражение опухолевых клеток значительно усиливается по сравнению с облучением на воздухе. Это дает основание использовать для избирательной защиты нормальной ткани методы облучения опухолей в условиях газовой (кислородной) гипоксии. В настоящее время продолжается поиск химических радиопротекторов, которые бы оказывали избирательное защитное действие только для нормальных тканей и в тоже время не защищали клетки опухолей от поражения.
При лечении многих онкологических заболеваний используется комплексная терапия, т. е. совместное применение облучения и химиотерапевтических препаратов, которые оказывают радиомоди-фицирующее действие. Облучение используется для подавления роста основной опухоли, а лекарственная терапия – для борьбы с метастазами.
В лучевой терапии широко используются тяжелые ядерные частицы – протоны, тяжелые ионы, π-мезоны и нейтроны разных энергий. Пучки тяжелых заряженных частиц создаются на ускорителях, имеют малое боковое рассеяние, что позволяет формировать дозовые поля с четким контуром по границе опухоли. Все частицы имеют одинаковую энергию и соответственно одинаковую глубину проникновения в ткань, что позволяет меньше облучать нормальные ткани, находящиеся по ходу пучка за пределами опухоли. У тяжелых заряженных частиц линейные потери энергии увеличиваются в конце пробега, поэтому создаваемая ими физическая доза в тканях не уменьшается с увеличением глубины проникновения, как при облучении редко ионизирующими излучениями, а возрастает. Увеличение поглощенной в тканях дозы излучения в конце пробега носит название пика Брэгга. Расширить пик Брэгга до размера опухоли можно при использовании на пути пробега частиц так называемых гребенчатых фильтров. На рисунке 6 приведены результаты оценки глубинного распределения дозы, создаваемого разными видами излучения, при облучении опухоли диаметром 4 см, располагающейся в теле на глубине 8–12 см.
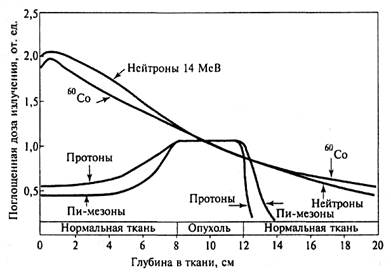
Рис. 6. Пространственное распределение поглощенной дозы излучений разных видов излучений
Если относительная доза облучения, равная единице, приходится на середину опухоли, т. е. 10 см от поверхности тела, тогда при гамма- и нейтронном облучении доза на входе пучка (т. е. в нормальных тканях) вдвое превышают дозу в центре опухоли. При этом облучение здоровых тканей происходит и после прохождения пучка излучений через злокачественную опухоль. Иная картина наблюдается при использовании тяжелых заряженных частиц (ускоренных протонов и π-мезонов), которые основную энергию передают непосредственно опухолям, а не нормальным тканям. Доза, поглощенная в опухоли, выше, чем доза, поглощенная в нормальных тканях, расположенных по ходу пучка, как до проникновения в опухоль, так и после выхода из опухоли.
Корпускулярную терапию (облучение ускоренными протонами, ионами гелия и водорода) используют при облучении опухолей, расположенных вблизи от критических органов. Например, если опухоль локализована рядом со спинным мозгом, тканями головного мозга, вблизи радиочувствительных органов малого таза, в глазном яблоке.
Нейтронная терапия оказалась наиболее эффективной при лечении нескольких видов медленно растущих опухолей (рака простаты, саркомы мягких тканей, рака слюнных желез). Для облучения используют быстрые нейтроны с энергией до 14 МэВ. В последние годы возрос интерес к нейтронзахватной терапии, для которой используются тепловые нейтроны с низкой энергией 0,25–10 кэВ, которые образуются в атомных реакторах и по отдельным каналам выводятся в расположенные рядом с реактором процедурные помещения. Для нейтронного захвата используются атомы бора-10 и гадолиния-157. При захвате нейтрона атомами бора-10 происходит его распад на атомы лития и альфа-частицы, пробег которых в тканях равен нескольким клеточным диаметрам, поэтому зона интенсивного воздействия излучения может ограничиваться только клетками, в которых будет высокое содержание бора. Захват нейтронов гадолинием-157 также приводит к распаду его ядер, который сопровождается гамма-излучением и образованием двух типов электронов – электорнов Оже и электронов конверсии. Электроны Оже имеют очень короткий пробег, поэтому, чтобы вызвать поражение клетки гадолиний должен находиться в самой клетке, однако гадолиний в клетку не проникает, поэтому основной поражающий эффект вызывают электроны конверсии, возникающие при распаде гадолиния в межклеточном пространстве. Для нейтронзахватной терапии необходимо обеспечить доставку бора и гадолиния непосредственно в опухолевые клетки или хотя бы в межклеточное пространство. Необходимым условием при этом является обеспечение поступления этих элементов только в опухолевые ткани исключая при этом возможность поступления их в клетки нормальных тканей. Для выполнения этого условия необходимо использование синтетических носителей бора и гадолиния.
Разные виды опухоли значительно различаются по скорости роста. Скорость опухолевого роста определяется не только длительностью клеточного цикла, но и долей постоянно погибающих и удаляемых из опухоли клеток. В нормальных тканях, оказавшихся в зоне облучения также имеются клетки в разных стадиях цикла, причем соотношение между делящимися и покоящимися клетками не одинаково в начале и в конце облучения. Глубина поражения клеток опухоли и нормальных тканей после однократного облучения определяется их исходной радиочувствительностью, а при фракционированном облучении – дополнительно и эффективностью восстановления клеток от сублетальных поражений. Если перерыв до второй фракции облучения составляет 6 и более часов, тогда возможна практически полная репарация повреждений данного вида клеток, поэтому эти клетки не погибают. Одновременно с восстановлением у некоторых видов клеток регистрируется гибель. Например, клетки лимфоидного происхождения начинают погибать уже в первые сутки после облучения. Гибель летально пораженных клеток другого происхождения (т. е. нелимфоидного), как опухолевых, так и здоровых тканей, растягивается на несколько дней и происходит, как во время очередного деления, так и спустя несколько часов после него. Клетки опухолей, находящиеся вне цикла, также как и покоящиеся клетки нормальных тканей, в течение определенного времени могут не проявлять признаков летального поражения. Непосредственно после облучения большинство опухолей продолжает рост даже после облучения высокой дозой, которая впоследствии приведет к гибели значительной части клеток. Это происходит по причине деления клеток, сохранивших жизнеспособность, а также по причине нескольких делений летально пораженных клеток.
Сразу после лучевого воздействия в опухоли возрастает доля относительно радиоустойчивых клеток, находящихся в момент воздействия в состоянии гипоксии и клеток, находящихся в наиболее радиоустойчивых фазах клеточного цикла. При получении стандартного курса лучевой терапии, когда фракции проводятся с интервалом 24 часа, к моменту очередного облучения клетки проходят следующие процессы. С одной стороны, благодаря восстановлению от потенциально летальных и сублетальных поражений, радиоустойчивость опухолевых и нормальных клеток повышается. С другой стороны, одновременное возобновление деления и переход клеток из наиболее радиоустойчивых стадий в более радиочувствительные, приводит к повышению радиочувстви-тельности. Эти процессы воспроизводятся после каждой фракции облучения, поэтому через некоторое время после начала курса облучения количество погибших клеток начинает превышать количество вновь образовавшихся клеток, поэтому опухоль уменьшается в объеме. По мере продолжения курса облучения наступает момент ускоренного деления клеток опухолевой и нормальной тканей, которое приводит к репопуляции этих тканей (или к самовосстановлению). Репопуляция осуществляется благодаря сохранившимся опухолевым клеткам, способным к делению, которые при этом получают достаточное количество питательных веществ и кислорода, поэтому рост опухоли возобновляется. При фракционированном облучении необходимо знать скорость репопуляции опухолей, потому что при фракционировании дозы незначительное увеличение интервала между фракциями может привести к возникновению динамического равновесия, при котором степень подавления роста опухоли на единицу дозы будет падать.
В настоящее время наиболее широко применяют курс лечебной терапии с ежедневным облучением опухоли дозой 2 Гр, при этом общая суммарная доза составляет 60 Гр, а общая длительность курса – 6 недель. Для повышения эффективности лучевой терапии используют новые режимы фракционирования дозы – мультифракционирование – ежедневное проведение 2–3-х фракций вместо одной, что способствует снижению тяжести отдаленных лучевых поражений. При лучевой терапии большинства злокачественных опухолей пока не возможно 100 %-ное излечение онкобольных.
ЗАКЛЮЧЕНИЕ
Таким образом, знание закономерностей биологического действия ионизирующего излучения на уровне клеток, микроорганизмов, а также организма растений и животных, позволяет широко применять ионизирующие излучения в различных радиационно-биологических технологиях.
Литература
1. Г р о д з и н с к и й Д. М. Радиобиология растений / Д.М. Гродзинский.Киев: Навукова думка, 1989. 384 с.
2.Г у л я е в, Г. В. Генетика. – 3-е изд., перераб. и доп. / Г.В. Гуляев. М.: Колос, 1984. 351 с.
3. И в а н о в с к и й, Ю. А. Эффект радиационной стимуляции при действии больших и малых доз ионизирующего облучения / Автореферат диссертации на соискание ученой степени доктора биологических наук. Владивосток. 2006 г. - 46 С.
4. К а у ш а н с к и й, Д. А., К у з и н, А.М. Радиационно-биологическая технология / Д.А. Каушанский, А.М. Кузин. М.: Энергоатомиздат. 1984. 152 С.
5. К у з и н, А. М., Каушанский, Д.А. Прикладная радиобиология: (теоретические и технические основы) / А.М. Кузин, Д.А. Каушанский. М.: Энергоатомиздат. 1981. 224 с.
6. Р а д и о б и о л о г и я / А.Д. Белов, В.А. Киршин, Н.П. Лысенко, В.В. Пак и др. /Под Ред. Белова. М.:Колос,1999. 384С.
7.С а м с о н о в а, Н. Е. Ионизирующая радиация и сельскохозяйственное производство. 2007г.
8. Я р м о н е н к о, С. П. Радиобиология человека и животных: Учеб. Пособие / С.П.Ярмоненко. – М.: Высш. Шк., 2004.– 549 с.
9.Использование радионуклидов и ионизирующих излучений в защите растений (сборник научных трудов) / Алма-Ата, Восточное отделение ВАСХНИЛ,1980. 132 с.
10. А н д р е е в, С. В., Е в л а х о в а, А. А. Радиоактивные изотопы в защите растений / С.В. Андреев, А.А. Евлахова,.Ленинград, «Колос», 1980. 71 с.
11.Радиационная обработка пищевых продуктов / под редакцией В. И. Рогачева. Москва, Атомиздат,1971. 241 с.
П Р И Л О Ж Е Н И Е
СОДЕРЖАНИЕ
Введение………………………………………………………………………………………..3
1.РАДИАЦИОННО-БИОЛОГИЧЕСКАЯ ТЕХНОЛОГИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
1.1. Области применения радиационно-биологической технологии……………………….4
1.2. Радиационный мутагенез как основа получения новых сортов сельскохозяйственных растений, микроорганизмов…………………………………………………………………..6
1.3.Использование стимуляционного действия ионизирующего излучения в отраслях сельского хозяйства…………………………………………………………………………..12
1.4.Использование ионизирующих излучений при производстве кормов и кормовых добавок для сельскохозяйственных животных……………………………………………..19
1.5.Применение ионизирующего излучения для радиационной стерилизации………….20 ветеринарных принадлежностей, бактерийных препаратов и для получения радиовакцин
1.6.Радиационная стерилизация животных и насекомых-вредителей……………………27
1.7. Использование радиоактивных изотопов в качестве индикаторов
в животноводстве……………………………………………………………………………..29
1.8. Использование радиоактивных изотопов в качестве индикаторов
в растениеводстве…………………………………………………………………………….31
1.9. Радиационное обеззараживание навоза и навозных стоков животноводческих ферм. Дезинфекция сырья животного происхождения при инфекционных заболеваниях……..31
2. РАДИАЦИОННО-БИОЛОГИЧЕСКАЯ ТЕХНОЛОГИЯ В ПЕРЕРАБАТЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ………………………………………………………………………32
2.1. Использование ионизирующих излучений в пищевой промышленности для продления сроков хранения продукции животноводства, растениеводства, овощеводства и рыбоводства…………………………………………………………………………………32
2.2..Изменение качества сырья с целью улучшения его технологической обработки…..39
2.3.Ускорение медленно идущих процессов в пищевой технологии…………………….41
3. РАДИАЦИОННО-БИОЛОГИЧЕСКАЯ ТЕХНОЛОГИЯ В МЕДИЦИНЕ……………..42
3.1.Использование ионизирующих излучений в медицинской промышленности, для диагностики и лечения болезней человека и животных…………………………………...42
3.2.Использование радиоактивных изотопов и ионизирующих излучений для диагностики и лечения болезней…………………………………………………………….44
ЗАКЛЮЧЕНИЕ……………………………………………………………………………….54
Приложения…………………………………………………………………………………..56
Радиационная стерилизация питательных сред для культивирования микробов и вирусов способствует повышению питательных свойств для некоторых видов микроорганизмов. Например, для азотфиксирующих клубеньковых бактерий. Лучшей питательной средой является торфяной нитрагит, подвергнутый радиационной стерилизации. При радиационной стерилизации субстрата повышается содержание микробных тел в готовом препарате и снижается зараженность посторонней микрофлорой, по сравнению с тепловой стерилизацией.
Дата публикования: 2015-11-01; Прочитано: 4928 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
